Физические и химические свойства углерода
Органическая жизнь на Земле представлена соединениями углерода. Элемент входит в состав главных компонентов клеточных структур: белков, углеводов и жиров, а также составляет основу вещества наследственности – дезоксирибонуклеиновой кислоты. В неорганической природе карбон является одним из самых распространенных элементов, образующих земную кору и атмосферу планеты. Органическая химия как раздел химической науки полностью посвящен свойствам химического элемента углерода и его соединений. Наша статья рассмотрит физико-химическую характеристику карбона и особенности его свойств.
Место элемента в периодической системе Менделеева
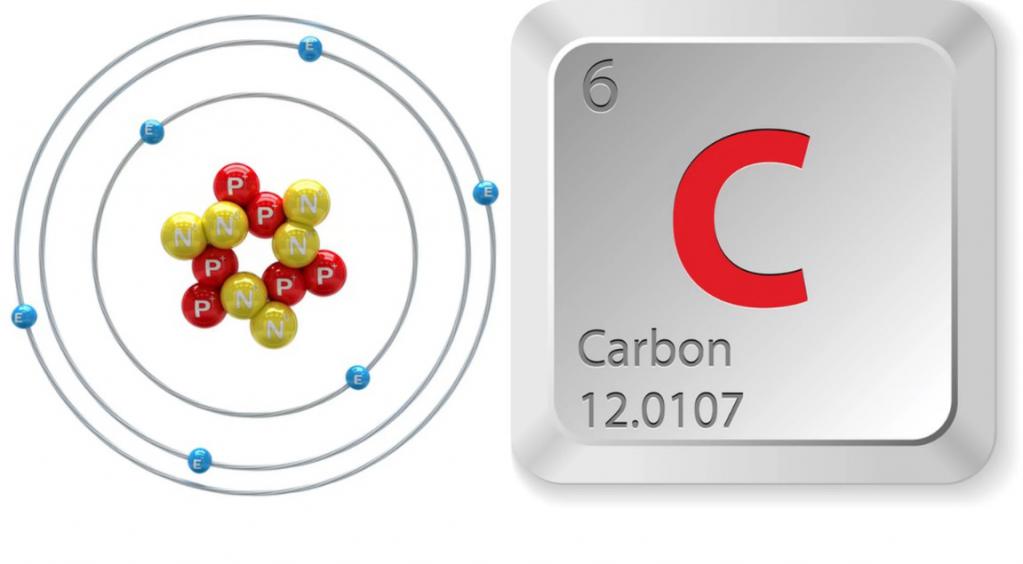
Подгруппа углерода – это главная подгруппа IV группы, в которую, кроме карбона, входят также кремний, германий, олово и свинец. Все перечисленные элементы имеют одинаковое строение внешнего энергетического уровня, на котором расположены четыре электрона. Это обуславливает сходство их химических свойств. В обычном состоянии элементы подгруппы двухвалентны, а когда их атомы переходят в возбужденное состояние, они проявляют валентность равную 4. Физические и химические свойства углерода зависят от состояния электронных оболочек его атома. Так, в реакции с кислородом элемент, частицы которого находятся в невозбужденном состоянии, образует безразличный оксид CO. Атомы же углерода в возбужденном состоянии окисляются до диоксида углерода, проявляющего кислотные свойства.

Формы углерода в природе
Алмаз, графит и карбин – это три аллотропных видоизменения углерода как простого вещества. Прозрачные кристаллы с высокой степенью преломления световых лучей, являющиеся самым твердыми соединениями в природе - это алмазы. Они плохо проводят тепло и являются диэлектриками. Кристаллическая решетка – атомная, очень прочная. В ней каждый атом элемента окружен четырьмя другими частицами, образуя правильный тетраэдр.
Совершенно другие физико-химические свойства углерода, образующего графит. Это жирное на ощупь кристаллическое вещество темно–серого цвета. Имеет послойную структуру, расстояния между слоями атомов достаточно велики, тогда как их силы притяжения слабые. Поэтому при надавливании на графитовый стержень вещество расслаивается на тонкие чешуйки. Они оставляют на бумаге темный след. Графит теплопроводен и немного уступает металлам в электропроводности.
Способность проводить электрический ток объясняется строением кристалла вещества. В нем частицы карбона связываются с тремя другими с помощью прочных ковалентных химических связей. Четвертый валентный электрон каждого атома остается свободным и способен перемещаться в толще вещества. Направленное движение отрицательно заряженных частиц и обуславливает появление электрического тока. Сферы применения графита разнообразны. Так, его используют для изготовления электродов в электротехнике и для проведения процесса электролиза, с помощью которого получают, например, щелочные металлы в чистом виде. Графит нашел применение в ядерных реакторах для контроля скорости проходящих в них цепных реакций в качестве замедлителя нейтронов. Известно применение вещества в качестве грифельных стержней или смазки в трущихся частях механизмов.
Что такое карбин?
Черный кристаллический порошок со стеклянным блеском – это карбин. Он был синтезирован в середине XX века в России. Вещество превосходит графит по твердости, химически пассивно, обладает свойствами полупроводника и является самым стабильным видоизменением карбона. Соединение является более прочным, чем графит. Существуют еще и такие формы углерода, химические свойства которых отличаются между собой. Это сажа, древесный уголь и кокс.
Различные характеристики аллотропных модификаций углерода объясняются строением их кристаллической решеток. Он представляет собой тугоплавкое вещество без цвета и запаха. В органических растворителях нерастворим, зато способен образовывать твердые растворы – сплавы, например, с железом.
Химические свойства углерода
В зависимости от того, с каким веществом реагирует карбон, он может проявлять двойственные свойства: как восстановителя, так и окислителя. Например, сплавляя кокс с металлами, получают их соединения – карбиды. В реакции с водородом образуются углеводороды. Это органические соединения, например, метан, этилен, ацетилен, в которых, как и в случае с металлами, карбон имеет степень окисления, равную -4. Восстановительные химические реакции углерода, свойства которого мы изучаем, проявляются во время его взаимодействия с кислородом, галогенами, водой и основными оксидами.
Оксиды карбона
Сжигая уголь на воздухе с низким содержанием кислорода, получают угарный газ – оксид двухвалентного карбона. Он бесцветен, не имеет запахи и сильно токсичен. Соединяясь с гемоглобином крови в процессе дыхания, окись углерода разносится по всему человеческому организму, вызывая отравление, а затем смерть от удушья. В классификации вещество занимает место безразличных оксидов, не реагирует с водой, ему не соответствует ни основание, ни кислота. Химические свойства углерода, имеющего валентность, равную 4, отличаются от ранее рассмотренной характеристики.
Углекислый газ
Бесцветное газообразное вещество при температуре 15 и давлении в одну атмосферу переходит в твердую фазу. Она называется сухим льдом. Молекулы CO2 неполярные, хотя ковалентная связь между атомами кислорода и карбона полярная. Соединение относится к кислотным оксидам. Взаимодействуя с водой, оно образует карбонатную кислоту. Известны реакции между углекислым газом и простыми веществами: металлами и неметаллами, например, с магнием, кальцием или коксом. В них он играет роль окислителя.
Качественная реакция на диоксид карбона
Чтобы убедиться, что исследуемый газ действительно является окисью углерода CO2, в неорганической химии проводят следующий опыт: вещество пропускают через прозрачный раствор известковой воды. Наблюдение помутнения раствора вследствие выпадения белого осадка карбоната кальция подтверждает присутствие в смеси реагентов молекул диоксида карбона. При дальнейшем пропускании газа через раствор гидроксида кальция осадок CaCO3 растворяется вследствие его превращения в гидрокарбонат кальция – водорастворимую соль.

Роль углерода в доменном процессе
Химические свойства углерода используются в промышленном производстве железа из его руд: магнитного, красного или бурого железняка. Главными среди них будут восстановительные свойства углерода и оксидов – угарного и углекислого газа. Процессы, происходящие в домне, можно представить в виде следующей последовательности реакций:
- Вначале кокс сгорает в потоке воздуха, раскаленного до 1 850 °C с образованием углекислого газа: С + О2 = СО2.
- Проходя через горячий углерод, он восстанавливается до монооксида карбона: СО2 + С = 2СО.
- Угарный газ реагирует с железной рудой, в результате получаем оксид железа: 3Fe2O3 + СО = 2Fe3O4 + СО2 ↑, Fe3O4 + СО = 3FeO + СО2 ↑.
- Реакция получения железа будет иметь следующий вид: FeO + СО = Fe + СО2
Расплавленное железо растворяет в себе смесь углерода и угарного газа, получается вещество – цементит.

Чугун, выплавленный в домне, кроме железа, содержит до 4,5 % углерода и другие примеси: марганец, фосфор, серу. Сталь, которая отличается от чугуна рядом признаков, например, способностью к прокатыванию и ковке, имеет в своем составе всего от 0,3 до 1,7 % карбона. Стальные изделия нашли широкое применение практически во всех отраслях промышленности: машиностроении, металлургии, медицине.
В нашей статье мы выяснили, какие химические свойства углерода и его соединений используются в различных сферах человеческой деятельности.
Похожие статьи
- Оксиды углерода: химия, 8 класс
- Что такое углерод? Описание, свойства и формула углерода
- Атом углерода: строение, особенности и свойства
- Диоксид углерода: формула, свойства и области применения
- Арены: химические свойства и способы получения
- Этот коварный угарный газ
- Органические соединения. Классы органических соединений
