Что такое углерод? Описание, свойства и формула углерода
Кратко рассказать о том, что такое углерод, невозможно. Ведь он – основа жизни. Данный элемент имеется во всех органических соединениях, и только он может формировать молекулы ДНК из миллионов атомов. Его свойства многочисленны, так что о нем стоит рассказать поподробней.
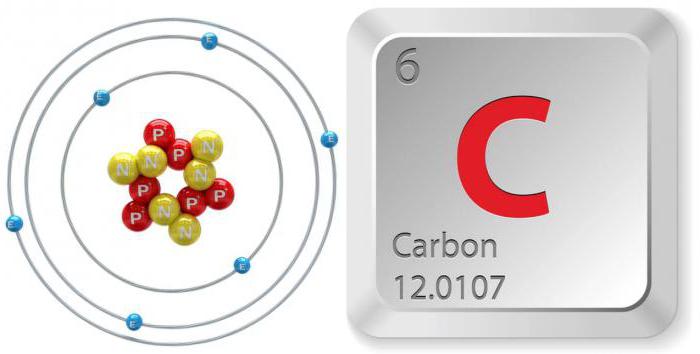
Формула, обозначения, особенности
Данный элемент, находящийся в таблице под порядковым номером шесть, обозначается символом «С». Электронная структурная формула углерода выглядит следующим образом: 1s2 2s2 2p2. Его масса – 12,0107 а.е.м. У этого вещества имеется:
- Два неспаренных электрона в основном состоянии. Проявляет валентность II.
- Четыре неспаренных электрона в возбужденном состоянии. Проявляет валентность IV.
Следует отметить, что определенная масса углерода содержится в земной коре. 0,023%, если быть точнее. Главным образом он накапливается в верхней части, в биосфере. Большая часть массы углерода литосферы накапливается в доломитах и известняках, в виде карбонатов.
Физические характеристики
Итак, что такое углерод? Это вещество, которое существует в огромном множестве аллотропных модификаций, и их физические свойства перечислять можно долго. А разнообразие веществ обуславливается способностью углерода к образованию химических связей отличающихся типов.
Что касательно свойств углерода, как простого вещества? Их можно обобщить следующим образом:
- При нормальных условиях плотность составляет 2,25 г/см³.
- Температура кипения равна 3506,85 °C.
- Молярная теплоемкость – 8,54 Дж/(K•моль).
- Критическая температура фазового перехода (когда газ не конденсируется ни при каком давлении) - 4130 К, 12 МПа.
- Молярный объем 5,3 см³/моль.
Также стоит перечислить углеродные модификации.
Из кристаллических веществ самыми известными являются: алмаз, карбин, графит, наноалмаз, фуллерит, лонсдейлит, фуллерен, а также углеродные волокна.
К аморфным образованиям относится: древесный, ископаемый и активированный уголь, антрацит, кокс, стеклоуглерод, сажа, техуглерод и нанопена.
Но ничто из перечисленного не является чистой аллотропной формой обсуждаемого вещества. Это лишь химические соединения, в которых углерод содержится в высокой концентрации.

Структура
Интересно, что электронные орбитали атома углерода не одинаковы. Они имеют разную геометрию. Все зависит от степени гибридизации. Есть три наиболее часто встречающиеся геометрии:
- Тетраэдрическая. Она образуется, когда происходит смешение трех р- и одного s-электронов. Такая геометрия атома углерода наблюдается у лонсдейлита и алмаза. Аналогичную структуру имеет метан и прочие углеводороды.
- Тригональная. Данную геометрию образует смешение двух р- и одной s-электронной орбитали. Еще один р-элемент не принимает участия в гибридизации, но он задействован при образовании π-связи с прочими атомами. Эта структура свойственна фенолу, графиту и прочим модификациям.
- Дигональная. Эта структура образуется вследствие смешения s- и р-электронов (по одному). Интересно, что выглядят электронные облака, как несимметричные гантели. Вытянуты они вдоль оного направления. Еще два р-электрона образуют пресловутые π-связи. Данная геометрия характерна для карбина.
Не так давно, в 2010 году, ученые из университета, который находится в Ноттингеме, открыли соединение, в котором сразу четыре атома оказались в одной плоскости. Его название – мономерный дилитио метандий.
Молекулы
О них стоит сказать в отдельности. Атомы обсуждаемого вещества могут соединяться, вследствие чего образуются сложные молекулы углерода. От насыщенных Na, С2 и Н2, между которыми слишком слабое притяжение, их отличает склонность конденсироваться в твердое состояние. Молекулы углерода могут оставаться в газообразном состоянии, только если поддерживать высокую температуру. Иначе вещество мгновенно затвердеет.
Некоторое время тому назад в США, в Берклеевской национальной лаборатории, была синтезирована новая форма твердого углерода. Это – С36. И его молекулу образует 36 углеродных атомов. Вещество образуется вместе с фуллеренами С60. Происходит это между двумя электродами графита, в условиях пламени дугового разряда. Ученые предполагают, что молекулы нового вещества обладают интересными химико-электрическими свойствами, которые пока не изучены.

Графит
Теперь можно более подробно рассказать о самых известных модификациях такого вещества, как углерод.
Графит – это самородный минерал со слоистой структурой. Вот его особенности:
- Он отлично проводит ток.
- Является относительно мягким веществом из-за своей низкой твердости.
- При нагревании в отсутствие воздуха проявляет устойчивость.
- Не плавится.
- На ощупь жирный, скользкий.
- В природном графите содержится 10-12% примесей. Как правило, это окислы железа и глины.
Если говорить о химических свойствах, то стоит отметить, что с солями и щелочными металлами это вещество образует так называемые соединения включения. Еще графит при высокой температуре реагирует с кислородом, сгорая до углекислого газа. Но вот контакт с неокисляющими кислотами никакого результата за собой не влечет – это вещество в них просто не растворяется.
Применяют графит в самых разных сферах. Его используют при изготовлении футеровочных плит и плавильных тиглей, в производстве нагревательных элементов и электродов. Без участия графита невозможно получить синтетические алмазы. Также он играет роль замедлителя нейтронов в ядерных реакторах. И, конечно же, из него делают стержни для карандашей, мешая с каолином. И это лишь часть сфер, где он используется.

Алмаз
Это метастабильный минерал, который может существовать неограниченное количество времени, что в некоторой степени обусловлено прочностью и плотностью углерода. Алмаз является самым твердым веществом по шкале Мооса, он легко разрезает стекло.
У него высокая теплопроводность, дисперсия, показатель преломления. Он износостойкий, а чтобы заставить его плавиться, нужна температура в 4000 °C и давление около 11 ГПа. Его особенность – люминесценция, способность светиться разными цветами.
Это редкое, хоть и распространенное вещество. Возраст минералов, согласно данным определенных исследований, может колебаться от 100 миллионов до 2,5 миллиарда лет. Обнаружены алмазы внеземного происхождения, возможно, даже досолнечного.
Этот минерал нашел свое применение в ювелирном деле. Ограненный алмаз, именуемый бриллиантом, стоит дорого, но статус драгоценности и красота сделали его еще более популярным. Кстати, также это вещество используют при изготовлении резцов, сверл, ножей и т. д. Благодаря своей исключительной твердости, минерал применяют во многих производствах.

Карбин
В продолжение темы о том, что такое углерод, нужно пару слов сказать и о такой его модификации, как карбин. Он выглядит как черный мелкокристаллический порошок, обладает полупроводниковыми свойствами. Получен искусственным образом в начале 60-х годов советскими учеными.
Особенность данного вещества заключается в увеличивающейся под световым воздействием проводимости. Именно поэтому его стали применять в фотоэлементах.

Графен
Это первый в мире двумерный кристалл. У данной модификации большая механическая жесткость, чем у графита, и рекордно высокая теплопроводность, составляющая ~5•103 Вт•м−1•К−. У носителей заряда графена высокая подвижность, именно поэтому вещество имеет перспективы в плане его использования в разных приложениях. Считается, что он может стать будущей основой наноэлектроники и даже заменить кремний в интегральных микросхемах.
Графен получают искусственно, в научных лабораториях. Для этого приходится прибегать к механическому отщеплению графитовых слоев от высокоориентированного вещества. Так получают образцы высокого качества с необходимой подвижностью носителей.
Его свойства изучены не полностью, но кое-что интересное ученые уже успели отметить. Например, в графене нет вингеровской кристаллизации. А в двойном слое вещества поведение электронов напоминает то, которое свойственно жидким кристаллам. Если соблюсти параметры скалывания на кристалле, удастся получить графеновую коробчатую наноструктуру.

Токсичность
Эту тему стоит отметить в заключение рассказа о том, что такое углерод. Дело в том, что это вещество выделяется в атмосферу вместе с выхлопными газами автомобилей. А еще при сжигании угля, подземной газификации и во многих других процессах.
Повышенное содержание этого вещества в воздухе приводит к увеличению численности заболеваний. В частности, это касается легких и верхних дыхательных путей. А токсическое действие обусловлено взаимодействием радиационного характера с β-частицами, которое ведет к тому, что химический состав молекулы меняется и свойства вещества – тоже.
Похожие статьи
- Что такое графит? Формула, свойства и применение графита
- Физические и химические свойства углерода
- Углеводороды - это соединения углерода с водородом, не содержащие других элементов. Классификация углеводородов
- Что такое чугун? Свойства, состав, получение и применение
- Электрод графитовый: характеристики, виды, использование
- Что такое вещество? Строение и свойства веществ
- Где содержатся углеводы: список продуктов
