Ионная связь: примеры соединений
В результате взаимного электростатического притяжения между молекулами и атомами химических элементов может возникнуть ионная связь. Примеры таких соединений можно наблюдать в различных реакциях гальванических батарей, даже простая поваренная соль имеет соединение данного типа. О том, что такое ионная связь, чем она отличается от ковалентной, рассказывается в этой статье.
Простые и сложные ионы
В ионной связи участвуют и отдельные атомы, и различные их соединения. Все участники такой связи имеют электрический заряд и удерживаются в соединении благодаря электростатическим силам. Различают ионы простые, такие как Na+, K+, которые относятся к катионам; F-, Cl- - относящиеся к анионам. Также бывают ионы сложные, состоящие из двух и более атомов. Примеры ионной химической связи на базе сложных ионов - анионы OH-, NO3-, катион NH4+. Простые ионы с положительным зарядом образуются из атомов с низким ионизационным потенциалом – обычно это металлы главных подгрупп I-II группы. Простые ионы, имеющие отрицательный заряд, в большинстве случаев являются типичными неметаллами.
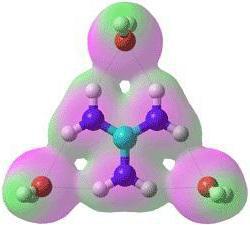
Ковалентная и ионная связь
Примеры систем, созданных из двух частиц, обладающих противоположными электрическими зарядами, показывают, что в таком случае всегда возникает электрическое поле. Это означает, что электрически активные ионы могут притягивать и другие ионы в различных направлениях. Благодаря силам электрического притяжения и существует ионная связь. Примеры таких соединений показывают два принципиальных различия между ионной и ковалентной связью.
- Электрическое поле иона уменьшается в зависимости от расстояния в любом направлении. Поэтому степень взаимодействия между ионами не зависит от того, как в пространстве эти ионы расположены. Из этих наблюдений можно сделать вывод, что ионная связь скалярна, то есть не обладает направленностью.
- Два иона, обладающие различными зарядами, притягивают не только друг друга, но и соседние заряженные ионы - к определенному иону могут присоединиться различное число заряженных частиц противоположного знака. В этом заключается еще одно различие между ковалентной и ионной связью: последняя не имеет насыщаемости. Число присоединенных ионов определяется линейными размерами заряженных частиц, а также тем принципом, что силы притяжения ионов противоположных зарядов должны преобладать над силами отталкивания, которые действуют между одинаково заряженными частицами.
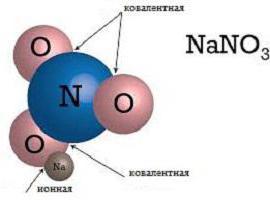
Ассоциации
Поскольку насыщаемость и направленность у ионов отсутствуют, то они склонны соединяться друг с другом в различных комбинациях. Это свойство ученые назвали ассоциацией. При высоких температурах ассоциация невелика: кинетическая энергия молекул и ионов довольно высока, и в газовом состоянии вещества с ионным видом связи находятся в виде отдельных молекул. Но средние и низкие температуры делают возможным образование различных структурных соединений, за образование которых несет ответственность ионный тип связи. Примеры строения веществ в жидком и твердом состоянии показаны на рисунках.
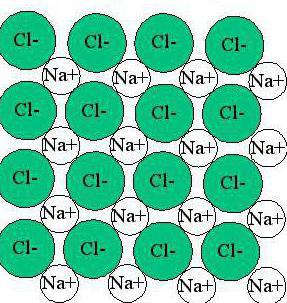
Как можно видеть, ионная связь создает кристаллическую решетку, в которой каждый элемент окружен ионами с противоположным знаком заряда. При этом такое вещество обладает одинаковыми характеристиками в различных направлениях.
Поляризация
Как известно, при присоединении электрона к атому неметалла выделяется определенное количество энергии. Однако присоединение второго электрона требует уже затрат энергии, поэтому образование простых многозарядных анионов становится энергетически убыточным. Вместе с тем такие элементы, как SO4 2-, СО32- показывают, что сложные многозарядные отрицательные ионы могут быть энергетически устойчивыми, так как электроны в соединении распределены таким образом, чтобы заряд каждого атома был не больше заряда самого электрона. Такие правила дикутует стандартная ионная связь.
Примеры типичных элементов, которые встречаются на каждом шагу (NaCl, CsF), не показывают полного разделения положительного и отрицательного зарядов. Например, в кристалле поваренной соли эффективный отрицательный заряд будет составлять всего около 93 % полного заряда электрона. Данный эффект наблюдается и в других соединениях. Такое неполное разделение зарядов называется поляризацией.
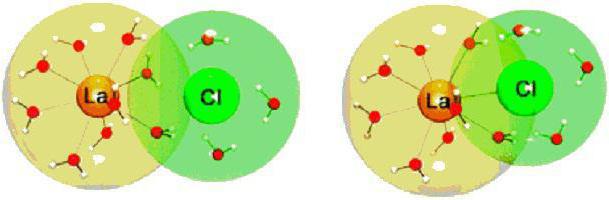
Причины поляризации
Причиной поляризации всегда является электрическое поле. Внешний слой электронов испытывает наибольшее смещение при поляризации. Однако следует заметить, что различные ионы имеют неодинаковую поляризуемость: чем слабее связь внешнего электрона с ядром, тем легче поляризуется весь ион и тем сильнее деформируется электронное облако.
Поляризация ионов оказывает известное действие на соединения, образующие ионную связь. Примеры химических реакций показывают, что наибольшим поляризующим действием обладает ион водорода Н+, поскольку он обладает наименьшими размерами и полным отсутствием электронного облака.
Похожие статьи
- Основные механические свойства твердых тел
- Ионная связь. Способ образования и свойства
- Ковалентная полярная связь: формула, свойства, особенности
- Металлическая связь: электроны в общественной собственности
- Ионы – это заряженные атомы и атомные группы. Понятие об ионных реакциях и заряде ионов
- Свойства и строение вещества: ковалентная неполярная связь, отличие от полярной
- Литий - что это такое? Атом, ядро, энергия лития. Литий-ионные аккумуляторы
