Химия. Оксиды: их классификация и свойства
Среди различных классов неорганических веществ выделяется комплекс бинарных соединений, состоящий из трех групп. Это кислотные, основные и амфотерные оксиды. Их классификация и свойства зависят от того, атомы какого химического элемента соединены с кислородом. В нашей статье мы ознакомимся с типичными химическими реакциями, характерными для окислов, а также выясним генетическую связь между ними и другими классами неорганических соединений: основаниями, кислотами и солями.
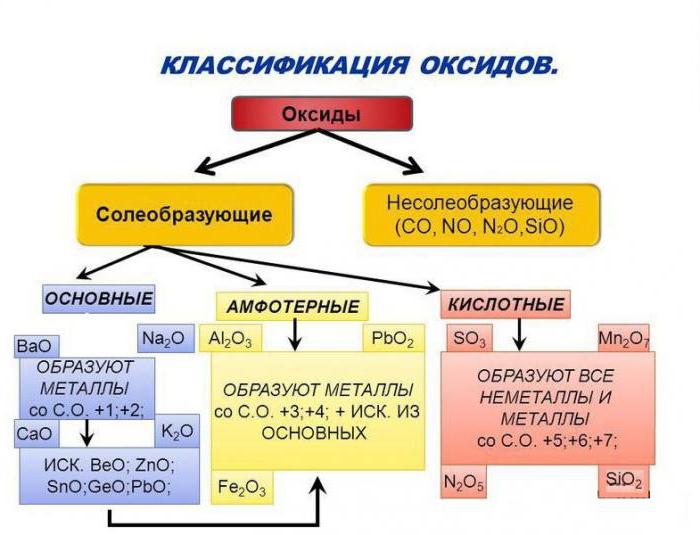
Особенности основных оксидов
Рассмотрим соединения, в состав которых входят атомы типичных металлов. Например: CuO, FeO, MgO содержат электронейтральные частицы меди, железа и магния, значит, это основные оксиды. Их классификация и свойства зависят от природы металлического элемента. Если в составе вещества присутствуют атомы щелочных или щелочноземельных металлов, то его молекулы способны взаимодействовать с водой.
Продуктом реакции, идущей с выделением большого количества тепла, будет щелочь, например едкий натр или гидроксид кальция. Некоторые окислы, такие как оксид меди или железа, напрямую с водой не реагируют, поэтому их основания получают косвенным путем: из соответствующих солей, взаимодействующих со щелочами. Главное же их свойство – реагировать с кислотами, образуя соль и воду.
Какие окислы называются кислотными?
Классификация и свойства кислот, оснований, оксидов, солей определяются, прежде всего, их способностью взаимодействовать между собой. Причем из веществ одного класса можно получить соединения другой группы. Так, из кислотных оксидов в их реакциях с водой образуются кислоты. Продуктом гидратации серного ангидрида, например, будет сульфатная кислота, а пропуская углекислый газ CO2 через воду, получим раствор слабой угольной кислоты. Поэтому кислотные оксиды, их классификация и свойства зависят от характера взаимодействия с водой и образования кислоты. Добавим еще, что в молекуле бинарного соединения с атомами кислорода связаны атомы неметаллических элементов. Важнейшим их свойством будет способность к реакциям со щелочами, продуктами же будут соль и вода.

Почему оксид алюминия реагирует с кислотами и щелочами?
Как вы заметили, основные оксиды взаимодействуют с кислотами, кислотные окислы реагируют со щелочами. Такие соединения, как Al2O3 или ZnO – это амфотерные оксиды. Их классификация и свойства базируются на способности этих веществ одновременно вступать в реакцию как с кислотами, так и с активными основаниями. При взаимодействии оксида алюминия, например, с сульфатной кислотой, получаем его сульфат. А в реакции этого же соединения с расплавом гидроксида натрия образуется соль - метаалюминат натрия.
Как видно, амфотерные элементы могут образовывать оксиды, сохраняющие способность к реакциям, как со щелочами, так и с кислотами. Они идут с образованием солей. Рассматривая оксиды, их классификацию и свойства, нельзя не сказать о еще одной группе этих бинарных соединений. Если вещество, например, CO – монооксид углерода, или NO – окись азота, не может реагировать ни с кислотами, ни со щелочами, то соединение неспособно образовывать соли. Такие оксиды и называют безразличными или индифферентными. Как мы помним, оксиды являются бинарными соединениями, в состав которых обязательно входит кислород.

Получение окислов
Продолжим рассматривать классификацию, свойства, получение оксидов. Можно выделить три способа, с помощью которых соединения добывают в лаборатории. Наиболее распространенный среди них – это окисление простых веществ. Горение сложных соединений, например природного газа или нефти, – еще один путь получения газообразных окислов углерода и водорода. К третьему способу мы отнесем термическое разложение некоторых солей угольной и нитратной кислот, а также нагревание нерастворимых в воде оснований, таких как гидроксид меди или железа. При этом образуются оксиды металлов и вода.
Взаимодействие оксидов между собой
Изучая оксиды, их классификацию и химические свойства, обратимся к реакциям между веществами кислотных и основных групп. В результате их образуются соединения, относящиеся к классу солей. Например, если через раствор оксида кальция (известковую воду) пропускать углекислый газ, то она мутнеет вследствие образования частиц нерастворимого карбоната кальция CaCO3. В промышленности широко применяют реакции взаимодействия нескольких веществ: оксидов натрия, кальция и кремния. Нагревая их смесь вместе с технической содой, получают стекло.
Особыми характеристиками обладает оксид водорода – вода, о них мы поговорим далее. H2O - самое распространенное и необходимое соединение на Земле. Способность ее молекул к образованию водородных связей обеспечивает главные свойства воды как универсального растворителя, обладающего специфическими свойствами: высокой теплоемкостью и теплопроводностью. Они очень важны для процессов обмена веществ в живых организмах.
Вода, как оксид, реагирует с различными кислотными и основными окислами. В первом случае получают кислоты, во втором – щелочи. Специфическая реакция оксида водорода – осуществлять реакции гидролитического разложения (гидролиза). Они очень распространены среди веществ органического происхождения. Это гидролиз белков, углеводов и жиров, проходящий в желудочно-кишечном тракте, расщепление целлюлозы микроорганизмами – сапротрофами и т. д.
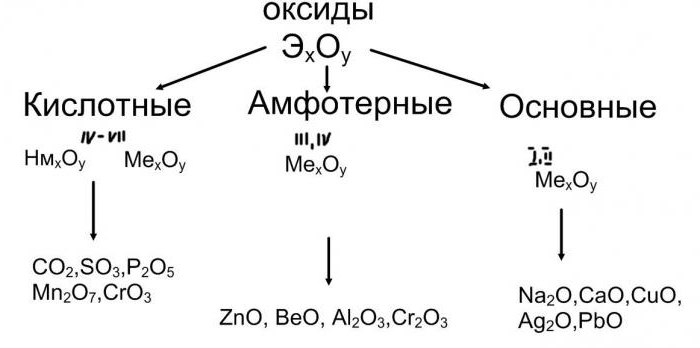
Оксиды, основания, соли: классификация, свойства
Между основными классами неорганических веществ существует генетическая связь, которая доказывает возможность их взаимного превращения. Так, из основного оксида активного металла можно получить основание, а из него – соль. Примером такой цепочки превращений служит следующая схема: оксид натрия – гидроксид натрия – карбонат натрия. Кислотные окислы служат исходными соединениями в реакциях с водой. Продукт, который получается в этом случае – кислота. Например: диоксид углерода – карбонатная кислота – карбонат натрия.
Реакция кислоты с гидроксидами, которая называется нейтрализацией, приведет к появлению солей. В обоих случаях конечным звеном генетической цепочки будет соединение этого класса, связывающее между собой превращения неметаллических и металлических химических элементов. Поэтому существует и обратный механизм: от соли – к основаниям, кислотам или к простому веществу.

В данной статье мы изучили классификацию и химические свойства основных классов неорганических веществ.
Похожие статьи
- Основные классы неорганических соединений
- Сернистый газ — физические свойства, получение и применение
- Оксид хрома: формула, характеристика и химические свойства
- Амфотерные оксиды и гидроксиды: физические и химические свойства, получение, применение
- Неорганическая химия: понятие, вопросы и задачи. Что изучает неорганическая химия
- Оксид меди (I, II, III): свойства, получение, применение
- Кислотные оксиды: химические свойства, получение, применение
