Строение газообразных, жидких и твердых тел кратко

При определенных условиях вся материя на планете Земля присутствует в одном из трех состояний: в газообразном, в жидком или в твердом. Существует также четвертое состояние материи, которое называется плазма. Рассмотрим вопрос строения газообразных, жидких и твердых тел, а также переход их из одного состояния в другое при изменении внешних условий.
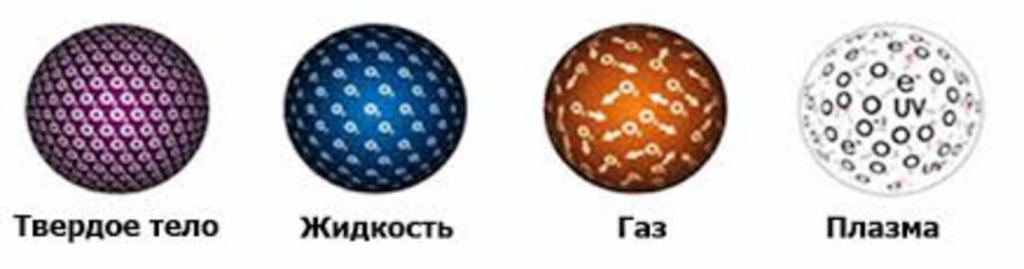
Твердое состояние материи
Твердые тела характеризуются способностью оказывать сопротивление внешним силам, которые на них воздействуют с целью изменения их формы и объема. Рассматривая вопрос о строении газообразных, жидких и твердых тел и останавливаясь на последних, нужно сказать, что молекулы в них прочно соединены друг с другом. Поэтому объект обладает конкретной формой, которую он сохраняет при неизменных внешних условиях.
Молекулы в твердом теле могут находиться в упорядоченном состоянии, тогда говорят о кристаллической структуре. Либо могут находиться в неупорядоченном состоянии, тогда речь идет об аморфных твердых телах. Ярким примером кристаллической решетки является структура металлических систем, которая в пространстве образует идеальную решетку конкретного типа, в узлах которой находятся ионы атомов. Примером твердого объекта с аморфной структурой является стекло.

Науки о твердой материи
Твердые тела изучает несколько наук, к которым относятся следующие:
- Физика конденсированного вещества. Она изучает твердую и жидкую материю, размеры которой превышают 1019 частиц, используя при этом экспериментальные и теоретические методы.
- Механика деформаций. Эта наука изучает механические свойства твердых тел, такие как напряжения в них, деформации упругие и пластические, а также связь этих свойств с термодинамическими внешними параметрами. При этом дисциплине неважно строение самого твердого вещества.
- Наука о материалах. Она изучает уже строение молекул твердых, жидких и газообразных тел, а также фазовые переходы между этими состояниями.
- Химия твердого состояния. Эта дисциплина специализируется на синтезе новых материалов в твердом состоянии.
Некоторые свойства твердых тел
При постоянном давлении и относительно низких температурах вещество находится в твердом состоянии. Воздействие небольшой внешней силы на твердое состояние не приводит к внешне различимой деформации твердого тела.
Если увеличивать силу, то тело начнет упруго деформироваться. При еще большем увеличении внешнего воздействия возможны два варианта:
- Если тело представляет собою металл, то оно начнет испытывать пластическую деформацию, то есть в его форме произойдут существенные изменения, которые останутся после прекращения внешнего воздействия.
- Если тело имеет аморфную структуру, либо кристаллическую структуру, но в узлах решетки будут находиться ионы разных знаков, например, кристалл поваренной соли NaCl, то тело не будет пластически деформироваться, а просто разрушится.
Каждое твердое тело характеризуется определенной плотностью. Самым легким веществом этой категории является аэрогель, его плотность составляет 3 кг/м3. Самым же плотным твердым материалом, известным человечеству, является металл - осмий. Один метр кубический осмия обладает массой 22 600 кг.
Металлические материалы
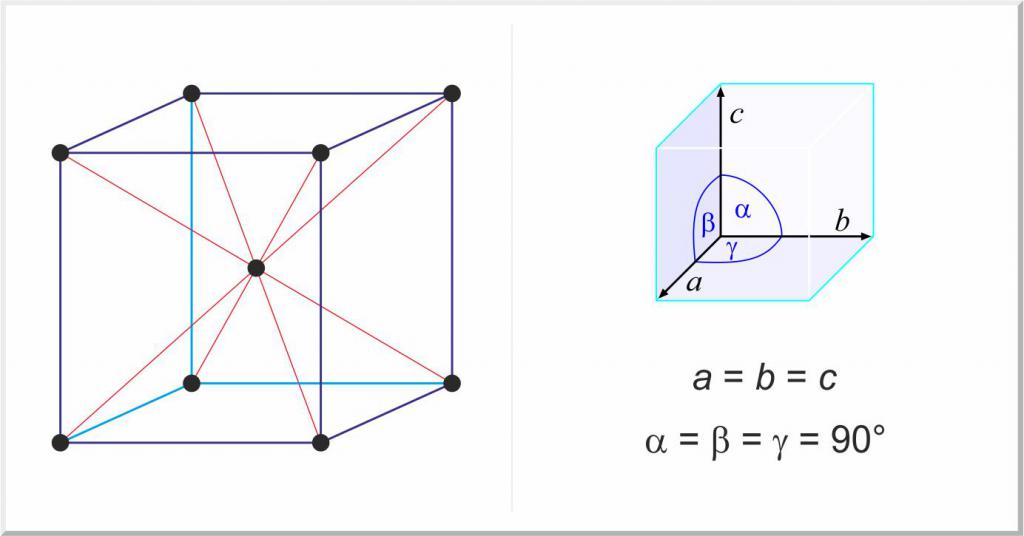
Особой группой твердых тел являются чистые металлы и их сплавы. Отличие в этом случае в строении твердых тел от газообразных и жидких состояний вещества заключается в существовании пространственной периодической решетки, которая называется кристаллической решеткой.

Благодаря кристаллической структуре металлы обладают рядом важнейших свойств, например, пластичностью и дифракцией. Практически все они существуют в трех основных кристаллических решетках:
- гранецентрированная кубическая, например, Au, Ag, Al, Cu;
- объемно-центрированная кубическая, например, Nb, Mo, W, Fe;
- гексагональная плотно упакованная, например, Ti, Zr.
Для изучения особенностей кристаллических решеток разработана наука кристаллография.
Конденсированное состояние вещества - жидкость
Жидкое состояние так же, как и твердое является несжимаемым, то есть сохраняет свой объем в значительном диапазоне давлений. Однако жидкость не сохраняет своей формы, что ее отличает от твердого тела и сближает с газообразным состоянием вещества.

Если в образовании твердых тел действуют молекулярные и атомные силы, то жидкость образована молекулами, которые соединены друг с другом только молекулярными слабыми силами. Самой распространенной на Земле является вода, которая, как и газ, может принимать форму сосуда, в который она помещена.
Если говорить о строении газообразных, жидких и твердых тел, то следует упомянуть, что жидкость, в отличие от газа, не изменяет свою плотность, когда ее помещают в какой-либо закрытый сосуд.
Особенности, присущие только жидкостям
Для каждой жидкости, благодаря наличию в ней молекулярных сил, присущи такие свойства, как поверхностное натяжение и капиллярный эффект. Если вещество находится в поле тяжести, например, нашей Земли, то любое помещенное в нее тело будет выталкиваться из жидкости согласно знаменитому закону Архимеда.

Если же на жидкость не действует гравитация, то выталкивающая сила будет равна нулю. Кроме того, в отсутствии внешних сил веществ в таком состоянии стремится приобрести наименьшую площадь поверхности, уменьшая тем самым полную энергию. Именно поэтому в условиях невесомости капли воды имеют сферическую форму, так как шар является фигурой с наименьшей площадью поверхности для этого объема жидкости.
Капиллярные свойства объясняются способностью молекул вступать в связи не только друг с другом, но и с атомами и молекулами других тел. Эти физические характеристики жидкости называются когезия и адгезия, соответственно.
Говоря кратко о строении газообразных, жидких и твердых тел, следует упомянуть свойство вязкости, которое присуще жидкому и газообразному состоянию. Под вязкостью понимается способность сопротивляться какому-либо смещению слоев вещества относительно друг друга при наличии градиента давления. Для жидкостей этот показатель зависит от скорости смещения этих слоев, температуры и молекулярной массы. Чем выше скорость движения тела в жидкости, чем больше молекулярная масса частиц жидкости, и чем ниже температура, тем больше вязкость.
Строение газов
Газом называется такое состояние материи, когда составляющие ее частицы не связаны какими-либо силами друг с другом либо эти силы очень слабы. Поэтому такие вещества свободно изменяют объем и форму, заполняя весь сосуд, в который их помещают. Это различие в строении газообразных тел от жидких и твердых приводит к тому, что они имеют меньшую плотность. В случае газообразного состояния воды принято вести речь о паре.

В реальных газах не существует абсолютного беспорядка. Однако молекулы в нем движутся настолько быстро, что они практически не взаимодействуют между собой. Поэтому газ заполняет абсолютно любой объем, и молекулы в нем будут разделены относительно большими расстояниями в сравнении с размерами самих молекул. Из-за большой дистанции между молекулами газы легко сжимаются, увеличивая при этом свою плотность и внутреннее давление.
Идеальный газ
В физике благодаря созданию моделей строения твердых, жидких и газообразных тел возникают некоторые разумные упрощения реальных состояний материи, которые позволяют использовать более простой математический аппарат для изучения этих состояний. Одной из таких моделей стала концепция идеального газа.
Под этим термином понимается газообразное состояние вещества, в котором молекулы имеют точечные размеры в сравнении с расстояниями между ними, и в котором они не взаимодействуют между собой.
При нормальных условиях, то есть при атмосферном давлении и комнатной температуре, большинство реальных газов могут рассматриваться, как идеальные. Например, азот, кислород, водород, благородные газы, углекислый газ и другие.
Уравнение состояния для идеального газа выглядит следующим образом:
P * V = n * R * T, где:
P, V, T и n - давление, объем, температура и количество вещества газа, соответственно,
R = 8,31 Дж/(моль*К) - универсальная постоянная.
Плазма - четвертое состояние вещества
При рассмотрении строения газообразных, жидких и твердых тел в 10 классе также уделяют внимание еще одному состоянию материи - плазме, которая представляет собой газ, состоящий из катионов и анионов, то есть из положительно и отрицательно заряженных частиц. Ярким примером плазмы является вещество, из которого состоит наше солнце.
По ряду свойств плазма похожа на газ, отличие заключается лишь в том, что она способна реагировать на магнитные поля, а также проводить электрический ток. Получить плазму можно разогревая до высоких температур газ, так как при этом индуцируются столкновения между молекулами, что приводит к их частичной или полной ионизации.
Изменение состояния вещества
В физике 10 класса строение газообразных, твердых и жидких тел рассматривается вместе с переходами между этими состояниями. Переходы между состояниями веществ возможны за счет изменения давления и температуры. Изменения происходят только в физическом строении газообразных, жидких и твердых телах, а их химический состав остается постоянным.
Возможны следующие переходы между различными состояниями материи:
- Плавление. Эндотермический процесс перехода из твердого состояния в жидкое.
- Кристаллизация. Экзотермический процесс, при котором жидкость становится твердым телом во время ее охлаждения.
- Кипение. Физический эндотермический процесс, при котором жидкость переходит в газ.
- Конденсация. Экзотермический переход газа в жидкость.
- Сублимация или возгонка. Эндотермический переход из твердого тела в газ, минуя жидкое состояние. Классическим примером является возгонка сухого льда.
Следует отметить, что все эндотермические и экзотермические процессы фазовых переходов идут с постоянной температурой вещества. Все эти процессы, существование которых обусловлено особенностями строения газообразных, жидких и твердых тел, являются энергетическими, то есть требуют либо подвод, либо отвод энергии во время их реализации.
Похожие статьи
- Основные свойства жидкостей
- Аномальные свойства воды: причины, значение
- Как сжижать газы? Производство и использование сжиженного газа
- Агрегатное состояние вещества. Изменение агрегатных состояний вещества
- Как расположены частицы в твердых телах: кристаллическая структура, физические свойства
- Кристаллическая решетка: понятие, виды, основные характеристики
- Что изучает физика и какова ее роль
