Формула внутренней энергии газа идеального. Пример задачи
Для получения представлений о свойствах различных физических объектов и процессов ученые часто прибегают к использованию упрощенных моделей. Одной из них является модель идеального газа. Используя ее, покажем, по какой формуле внутренняя энергия газа вычисляется.
Концепция газа идеального
Под газом идеальным понимают такой газ, частицы которого друг с другом не взаимодействуют, хаотически движутся в пространстве в разных направлениях, вероятность их столкновений между собой практически равна нулю, расстояния между частицами велики по сравнению с их линейными размерами.
Единственным процессом, который наблюдается экспериментально в макроскопическом масштабе в идеальной газовой системе, является столкновение молекул со стенками сосуда. Эти столкновения считаются абсолютно упругими, то есть в результате у них сохраняется импульс частиц и их кинетическая энергия. Рассмотренный процесс является причиной давления в газах.
Идеальным с высокой степенью точности можно считать любой газ, который при атмосферных давлениях и комнатных температурах находится в термодинамическом равновесии. Более того, система должна состоять из химически нейтральных молекул и атомов, например молекулы N2, O2 или благородные газы He, Ar и другие.
Внутренняя энергия идеального газа
Понятие энергии в физике тесно связано с возможностью совершения работы. При этом часто выделяют энергию потенциальную, которая заключена в химических связях между элементами системы, и энергию кинетическую, связанную с поступательным и вращательным перемещением в пространстве этих элементов.
Под внутренней энергией понимают физическую величину, которая соответствует сумме потенциальной и кинетической энергий системы.
Применительно к идеальной газовой системе понятия внутренней энергии получаем, что она должна равняться ее кинетической энергии. Действительно, так как между молекулами и атомами идеального газа не существует взаимодействий, то потенциальная энергия системы будет равна нулю. Таким образом, для газа идеального всегда справедливо равенство:
U = Ek
Чтобы записать формулу энергии внутренней газа идеального, следует вычислить величину Ek для него.
Определение кинетической энергии
Рассмотрим закрытую систему с идеальным газом. Предположим, что количество частиц в этой системе равно N. Для простоты предположим, что все частицы являются одинаковыми. Каждая из них имеет массу m и движется с некоторой скоростью v. Вся система находится в термодинамическом равновесии при абсолютной температуре T. Кинетическую энергию системы можно определить по следующей формуле:
Ek = m / 2 × ∑i=1N (vi2)
Если правую часть равенства умножить и поделить на число N, то множитель суммы будет равен средней квадратичной скорости <v>. В таком случае формула кинетической энергии запишется так:
Ek = N × m × <v>2 / 2
Теперь вспомним формулу, которая связывает среднюю кинетическую энергию одной молекулы с температурой системы:
m × <v>2 / 2 = z / 2 × kB × T
Где kB - константа Больцмана, z - число степеней свободы.
Подставляя это выражение в формулу для полной кинетической энергии Ek, получим равенство:
Ek = z/2 × kB × T × N
Формула внутренней энергии газа
Исходя из формулы для Ek, полученной выше, остается лишь заменить левую часть равенства на символ U, чтобы получить соответствующее выражение для энергии внутренней, имеем:
U = z/2 × kB × T × N
Ввиду большого значения N пользоваться этим выражением на практике крайне неудобно. Поэтому данное равенство записывают в несколько иной форме, используя понятия универсальной газовой константы R и количества вещества n. Несложно показать, что справедливо следующее равенство:
n × R = kB × N
Тогда величина U запишется так:
U= z/2 × n × R × T
Чем выше температура в системе, тем больше ее внутренняя энергия.
Теперь скажем несколько слов о величине z. В случае одноатомного газа она равна трем (три поступательных степени свободы). Это значит, что U определится так:
U1= 3/2 × n × R × T
Если молекула газа состоит из двух атомов, то z = 5 (к трем поступательным степеням свободы добавляются еще две вращательные). Внутренняя энергия газа двухатомного рассчитывается так:
U2= 5/2 × n × R × T
Наконец, если молекулы газа являются более сложными, то z = 6 (3 поступательных и 3 вращательных степени), и формула для U примет вид:
U3= 3 × n × R × T
Пример решения типичной задачи

Углекислый газ находится в баллоне объемом 15 литров. Баллон нагревают, и его давление изменяется на величину 0,5 атмосферы. Как изменяется внутренняя энергия газа в результате нагрева?
Решить задачу можно быстро, если вспомнить уравнение состояния для идеального газа. Вот оно:
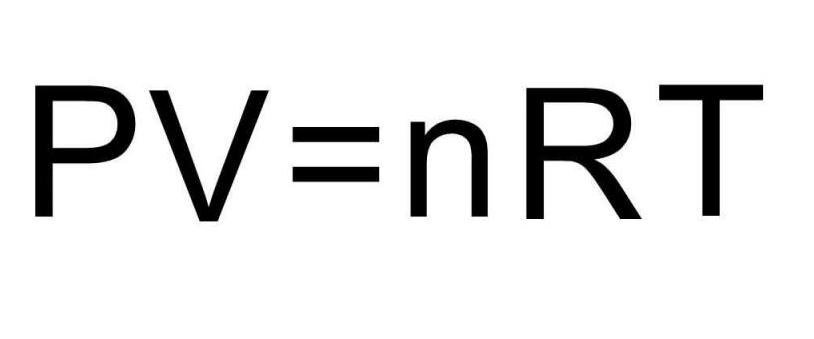
В соответствии с условием задачи мы изучаем изохорный термодинамический процесс в закрытой системе, то есть V=const и n=const. В результате нагрева в системе меняется только давление и температура, при этом остается справедливым равенство:
ΔP × V = n × R × ΔT
В свою очередь, формула внутренней энергии газа CO2 для этого процесса имеет вид:
ΔU3= 3 × n × R × ΔT
Заметим, что молекула CO2 является трехатомной, поэтому для нее z = 6. Сравнивая два последних равенства, приходим к конечной формуле:
ΔU3= 3 × ΔP × V
Остается перевести изменение давления и объем из условия задачи в единицы СИ, подставить их в полученное равенство и записать ответ: ΔU3 = +2280 Дж.
Похожие статьи
- Рассказ о моей семье на английском с переводом. Пример
- Известные русские химики: список, достижения, открытия и интересные факты
- Где живет слепая ясновидящая баба Нина: адрес и отзывы
- Характеристика Льва-женщины. Знак Зодиака Лев: описание
- Специальность "Технология машиностроения". Кем можно работать?
- Интересные темы для проекта. Проектная деятельность школьников
- Значение колец на пальцах у женщин. Как носить кольца
