Определение, уравнения и характеристика адиабатического процесса
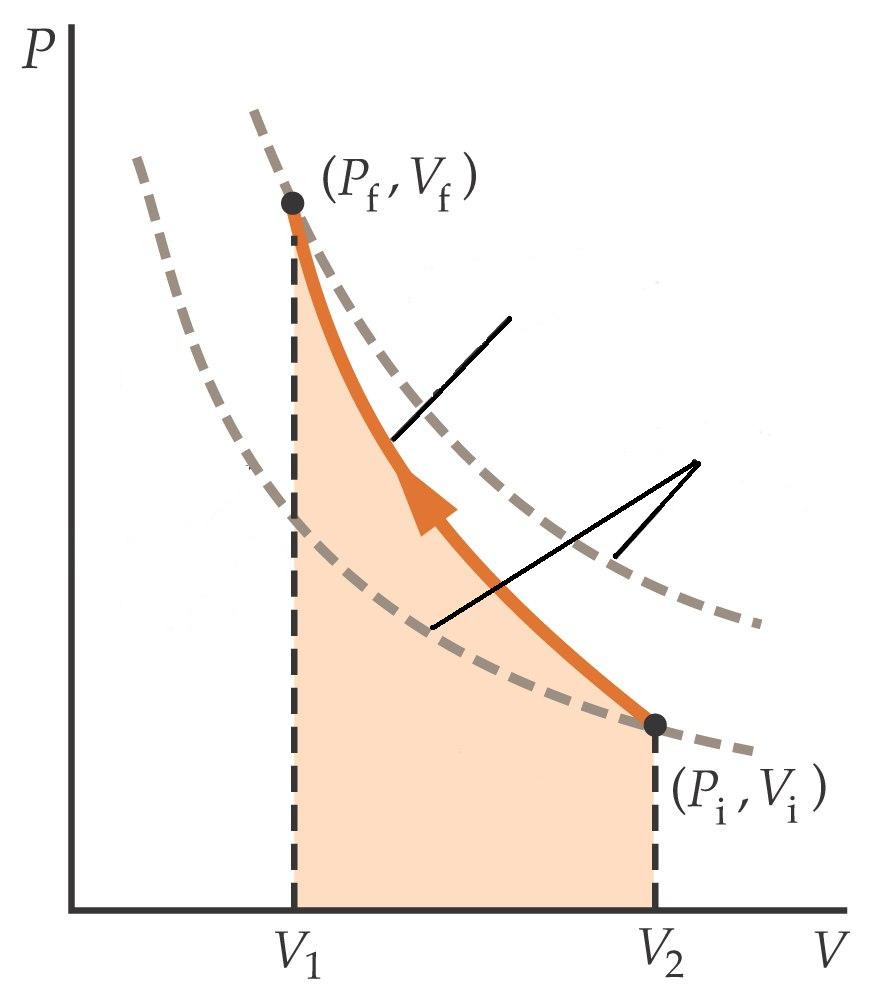
Переходы между разными состояниями системы являются основным объектом изучения термодинамики. Одним из таких преобразований, которое играет важную роль в технике и природе, является адиабатический процесс. Что он собой представляет и какими уравнениями описывается, рассматривается в данной статье.
Определение адиабатического процесса
Если переход между двумя состояниями осуществляется только за счет внутренних энергетических резервов рассматриваемой системы, то он называется адиабатическим. В результате этого за счет таких ресурсов выполняется некоторая работа.
Адиабатический процесс характерен для систем, которые могут легко сжиматься и расширяться. Этим условиям удовлетворяют все газы. Обмен теплотой с окружающей средой во время протекания этого процесса практически отсутствует потому, что скорость адиабатического перехода оказывается очень большой. С другой стороны, она может быть маленькой, но при этом система должна обладать хорошей теплоизоляцией.
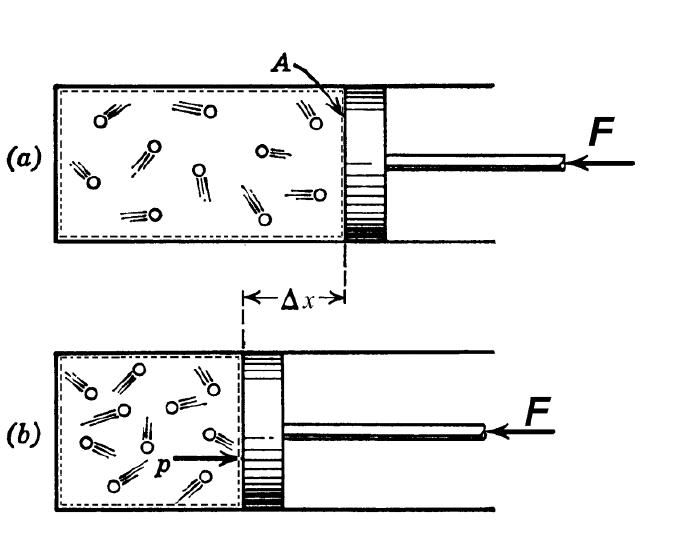
Графики и уравнения адиабатического процесса проще всего изучать на примере идеальных газов, у которых внутренняя энергия точно равна кинетической энергии молекул.
Формулы Пуассона

Рассмотрим подробнее. Те, кто знаком с физикой идеального газа, знают, что каждое преобразование в такой системе подчиняется некоторым уравнениям. Например, изотермический процесс описывается законом Бойля-Мариотта, изобарный - законом Шарля, изохорный - законом Гей-Люссака. Справедливо это и для рассматриваемой нами системы. Закон адиабатического процесса тоже имеет свое математическое выражение в виде уравнений Пуассона. Получим их.
В соответствии с определением изучаемого процесса можно записать следующее выражение:
dU = -P * dV
Это равенство является первым законом термодинамики, который устанавливает сохранение энергии в системе. В частности, работа P*dV выполняется только за счет изменения внутренней энергии dU. Чтобы получить уравнения Пуассона, вспомним следующие соотношения для идеального газа:
dU = CV * dT;
P * V = R * T;
CP - CV = R
Первое равенство говорит о том, что при изохорном процессе изменение внутренней энергии оказывается прямо пропорциональным температуре, где CV - изохорная теплоемкость. Второе выражение - это закон Клапейрона-Менделеева для 1 моль идеального газа. Наконец, третье равенство устанавливает связь между изобарной CP и изохорной CV теплоемкостью и газовой постоянной R для 1 моль вещества. Применение всех этих выражений позволяет получить следующие уравнения адиабатического процесса:
P * Vγ = const;
T * Vγ-1 = const;
T * Pγ / (γ-1) = const
Все три уравнения имеют отношение к французскому математику и физику XIX века Симеону Пуассону.
Физический смысл
Величина γ называется показателем адиабаты. Он математически равен отношению теплоемкостей CP и CV. Поскольку изобарная теплоемкость всегда больше изохорной, то γ будет больше 1. Почему это происходит? В случае изобарного процесса подводимая к системе теплота расходуется не только на ее нагрев, но и на совершение системой работы.
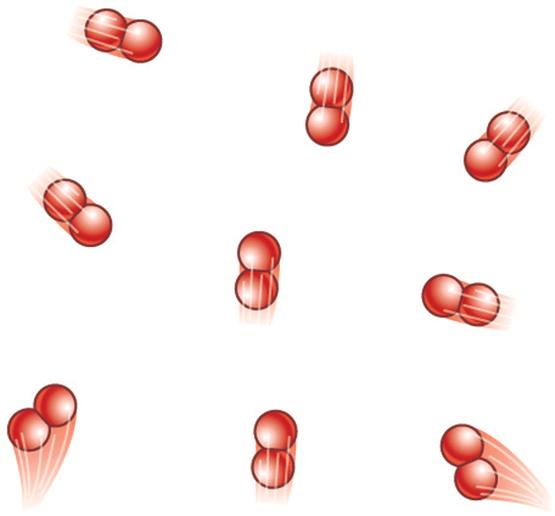
На показатель адиабаты не влияет химический состав газа, однако он зависит от количества степеней свободы, составляющих систему молекул. В общем случае справедлива следующая формула:
γ = (f + 2) / f
Здесь f - число степеней свободы. Для одноатомного газа оно равно 3, для двухатомного - 5, а для многоатомного - 6. С учетом этих цифр получаем значения γ:
γ = 1,67 (для одноатомного);
γ = 1,4 (для двухатомного);
γ = 1,33 (для многоатомного)
В случае газовой смеси, в которую входят молекулы с разным числом атомов, следует рассчитывать среднее значение γ с учетом атомных долей компонентов. Например, земной воздух на 99 % состоит из двухатомных молекул N2 и O2, то есть для него показатель γ для стандартных условий практически равен 1,4.
Адиабатический и изотермический процессы
Рассмотрим следующие преобразования. Знакомые с физикой люди могли заметить, что уравнение Пуассона, выраженное через термодинамические параметры P и V, по своей форме совпадает с выражением Бойля-Мариотта для изотермического процесса в идеальном газе. Последнее имеет вид:
P * V = const
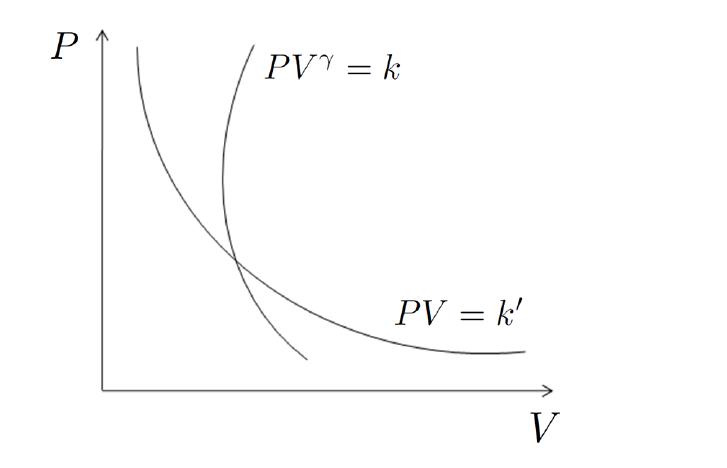
Если изобразить графики адиабатического и изотермического процессов в осях P-V, то можно увидеть, что первая кривая будет идти более резко, чем вторая. Иными словами, давление в случае адиабатического перехода падает быстрее, чем в случае изотермического преобразования. Поясним этот факт. Следует вспомнить, что при изотермическом расширении в систему поставляется некоторое количество энергии для поддержания температуры в ней, что способствует более медленному снижению давления.
Похожие статьи
- Общая характеристика русской литературы 19 века: описание, особенности и интересные факты
- Устное народное творчество: виды, жанры произведений и примеры
- Где провести выпускной для 4 класса: интересные идеи и рекомендации
- Теория вероятности: формулы и примеры решения задач
- 5 стадий принятия неизбежного. Психология человека
- Специальность "Технология машиностроения". Кем можно работать?
- Многочлены. Разложение многочлена на множители: способы, примеры
