Теория электролитической диссоциации — одна из основных в химии
Вещества-электролиты при растворении в воде распадаются на заряженные частицы — ионы. Обратное явление — моляризация, или ассоциация. Образование ионов объясняет теория электролитической диссоциации (Аррениус, 1887). На механизм распада химических соединений при расплавлении и растворении влияют особенности типов химических связей, строение и характер растворителя.
Электролиты и непроводники
В растворах и расплавах происходит разрушение кристаллических решеток и молекул — электролитическая диссоциация (ЭД). Распад веществ сопровождается образованием ионов, появлением такого свойства, как электропроводность. Не каждое соединение способно диссоциировать, а только вещества, которые изначально состоят из ионов либо сильно полярных частиц. Присутствием свободных ионов объясняется свойство электролитов проводить ток. Обладают такой способностью основания, соли, многие неорганические и некоторые органические кислоты. Непроводники состоят из малополярных или неполяризованных молекул. Они не распадаются на ионы, являясь неэлектролитами (многие органические соединения). Переносчики зарядов — положительные и отрицательные ионы (катионы и анионы).
Роль С. Аррениуса и других химиков в изучении диссоциации
Теория электролитической диссоциации обоснована в 1887 году ученым из Швеции С. Аррениусом. Но первые обширные исследования свойств растворов были проведены еще русским ученым М. Ломоносовым. Внесли вклад в изучение заряженных частиц, возникающих при растворении веществ, Т. Гротгус и М. Фарадей, Р. Ленц. Аррениус доказал, что электролитами являются многие неорганические и некоторые органические соединения. Шведский ученый объяснил электропроводность растворов распадом вещества на ионы. Теория электролитической диссоциации Аррениуса не придавала значения непосредственному участию молекул воды в этом процессе. Русские ученые Менделеев, Каблуков, Коновалов и другие считали, что происходит сольватация — взаимодействие растворителя и растворенного вещества. Когда идет речь о водных системах, то применяется название «гидратация». Это сложный физико-химический процесс, о чем свидетельствует образование гидратов, тепловые явления, изменение цвета вещества и появление осадка.

Основные положения теории электролитической диссоциации (ТЭД)
Многие ученые работали над уточнением теории С. Аррениуса. Потребовалось ее усовершенствование с учетом современных данных о строении атома, химической связи. Сформулированы основные положения ТЭД, отличающиеся от классических тезисов конца XIX века:
- Процесс расплавления либо растворения сопровождается диссоциацией электролита на ионы. Так (по предложению Фарадея) называют частицы, обладающие зарядом («+» или «–») Они отличаются от нейтральных атомов строением валентных оболочек и устойчивостью, бывают окрашенными и бесцветными. Ионы могут быть простыми: Na+, Cl-, S2-, Al3+. Есть заряженные частицы, состоящие из групп атомов: CO2-, NH4+. С греческого языка название «ион» переводится как «странствующий», что указывает на хаотичность распространения этих частиц.
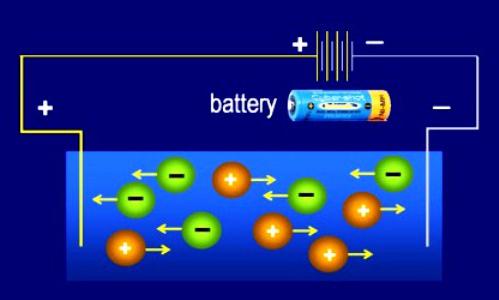
- Воздействие внешнего электрического поля приводит ионы в упорядоченное движение внутри пространства электролита. Каждая отрицательная частица направляется к аноду (положительному электроду). Ионы со знаком "+" начинают движение в сторону катода (отрицательного электрода).
- Одновременно в растворах происходит распад на ионы и соединение этих частиц, поэтому диссоциация относится к обратимым физико-химическим процессам.
Происходящие явления необходимо учитывать при составлении уравнений: применить специальный знак обратимого процесса, подсчитать отрицательные и положительные заряды: они в сумме должны совпадать.
Механизм ЭД ионных веществ
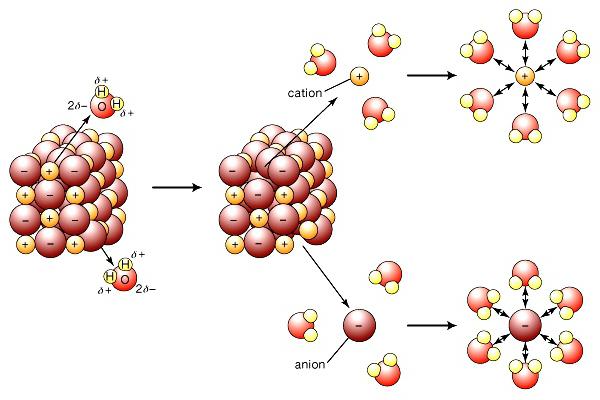
Современная теория электролитической диссоциации учитывает строение веществ-электролитов и растворителей. При растворении связи между разноименно заряженными частицами в ионных кристаллах разрушаются под воздействием полярных молекул воды. Они буквально «вытягивают» ионы из общей массы в раствор. Распад сопровождается образованием вокруг ионов сольватной (в воде — гидратной) оболочки. Кроме воды, повышенной диэлектрической проницаемостью обладают кетоны, низшие спирты. При диссоциации хлорида натрия на ионы Na+ и Cl- регистрируется начальная стадия, которая сопровождается ориентацией диполей воды относительно поверхностных ионов в кристалле. На заключительном этапе гидратированные ионы освобождаются и диффундируют в жидкость.
Механизм ЭД соединений с ковалентной сильнополярной связью
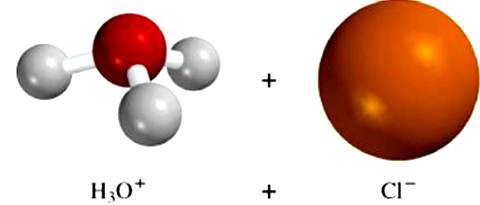
Молекулы растворителя влияют на элементы кристаллического строения неионных веществ. Например, воздействие диполей воды на хлороводородную кислоту приводит к изменению типа связи в молекуле с ковалентной полярной на ионную. Вещество диссоциирует, в раствор поступают гидратированные ионы водорода и хлора. Этот пример доказывает важность тех процессов, которые возникают между частицами растворителя и растворенного соединения. Именно это взаимодействие приводит к образованию ионов электролита.
Теория электролитической диссоциации и основные классы неорганических соединений
В свете основных положений ТЭД кислотой можно назвать электролит, при распаде которого из положительных ионов можно обнаружить только протон Н+. Диссоциация основания сопровождается образованием или освобождением из кристаллической решетки только аниона ОН- и катиона металла. Нормальная соль при растворении дает положительный ион металла и отрицательный — остатка кислоты. Основная соль отличается наличием двух видов анионов: ОН-группы и кислотного остатка. В кислой соли из катионов присутствуют только водород и металл.
Сила электролитов
Для характеристики состояния вещества в растворе используется физическая величина — степень диссоциации (α). Находят ее значение из отношения количества распавшихся молекул к общему их числу в растворе. Глубину диссоциации определяют разные условия. Важны диэлектрические показатели растворителя, структура растворенного соединения. Обычно степень диссоциации понижается с ростом концентрации и увеличивается при повышении температуры. Зачастую степень диссоциации конкретного вещества выражают в долях от единицы.
Классификация электролитов
Теория электролитической диссоциации в конце XIX века не содержала положения о взаимодействии ионов в растворе. Несущественным казалось Аррениусу влияние молекул воды на распределение катионов и анионов. Представления Аррениуса о сильных и слабых электролитах были формальными. Исходя из классических положений, можно получить значение α = 0,75–0,95 для сильных электролитов. В экспериментах доказана необратимость их диссоциации (α →1). Практически полностью распадаются на ионы растворимые соли, серная и соляная кислоты, щелочи. Частично диссоциируют сернистая, азотистая, плавиковая, ортофосфорная кислоты. Слабыми электролитами считаются кремниевая, уксусная, сероводородная и угольная кислоты, гидроксид аммония, нерастворимые основания. Воду также относят к слабым электролитам. Диссоциирует небольшая часть молекул Н2О, одновременно происходит моляризация ионов.
Похожие статьи
- Степень диссоциации, электролиты и положения теории электролитической диссоциации
- Гидролиз солей. Какие соли подвергаются гидролизу
- Электролитическая диссоциация: уравнение, степень, константа, реакции
- Неорганическая химия: понятие, вопросы и задачи. Что изучает неорганическая химия
- Изотонический коэффициент в растворах электролитов и неэлектролитов
- Электролиз воды: что нам о нем известно
- Лимфа: что такое и как ее очистить. Симптомы лимфом

