Электролитическая диссоциация: уравнение, степень, константа, реакции
Фундаментальной опорой химии, наравне с периодической системой Д. И. Менделеева, строением органических соединений А. М. Бутлерова, другими значимыми открытиями, является и теория электролитической диссоциации. В 1887 году она была разработана Сванте Аррениусом для объяснения специфического поведения электролитов в воде, других полярных жидкостях и расплавах. Он нашёл компромисс между двумя категорически разными, существующими на то время теориями о растворах – физической и химической. Первая утверждала, что растворённое вещество и растворитель никак друг с другом не взаимодействуют, образуя простую механическую смесь. Вторая, что между ними происходит химическая связь. Оказалось, что на самом деле растворам присущи и те, и другие свойства.
В последующих этапах развития науки многие учёные продолжали исследования и разработки в этой области, опираясь на имеющиеся сведения о строении атомов и природе химических связей между ними. В частности И. А. Каблуков занимался вопросом сольватационных процессов, В. А. Кистяковский определил зависимость поднятия столба жидкости в капилляре в условиях температуры кипения от молекулярного веса.
Современная трактовка теории
До появления данного открытия многие свойства и обстоятельства процессов расщепления были не изучены, как и сами растворы. Электролитическая диссоциация – это процесс распада вещества на составляющие его ионы в воде или других полярных жидкостях, взаимодействия частиц соединения с молекулами растворителя, появления подвижности катионов и анионов в узлах кристаллической решетки из-за расплавления. В результате этого образованные субстанции получают новое свойство – электрическую проводимость.

Состав, классификация и названия заряженных частиц в свете электролитической диссоциации
Ионом называют атом или группу атомов, которые являются носителями положительного или отрицательного заряда. Им присуще условное подразделение на простые (К(+), Са(2+), Н(+) – состоящие из одного химического элемента), сложные и комплексные (ОН(-), SO4(2-), НСО3(-) – из нескольких). Если катион или анион связан с молекулой растворителя, он называется сольватированным, с диполем молекулы Н2О – гидратированным.
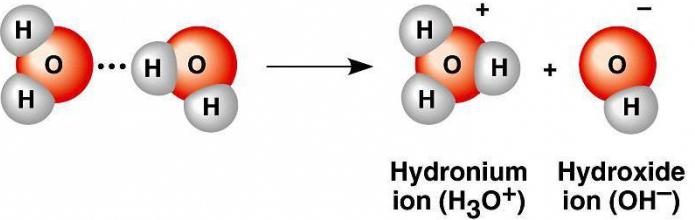
Когда происходит электролитическая диссоциация воды, образуется две заряженные частицы Н(+) и ОН(-). Протон водорода принимает на вакантную орбиталь неподелённую электронную пару кислорода из другой молекулы воды, в результате чего образуется ион гидроксония Н3О(+).
Основные положения открытия Аррениуса
Все представители классов неорганических соединений, кроме оксидов, в растворах ориентированных диполей жидкостей распадаются, говоря химическим языком – диссоциируют на составляющие их ионы в большей или меньшей степени. Наличия электрического тока этот процесс не требует, уравнение электролитической диссоциации является его схематической записью.
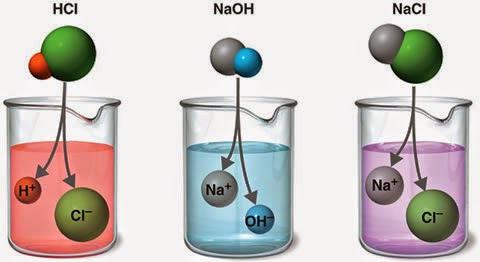
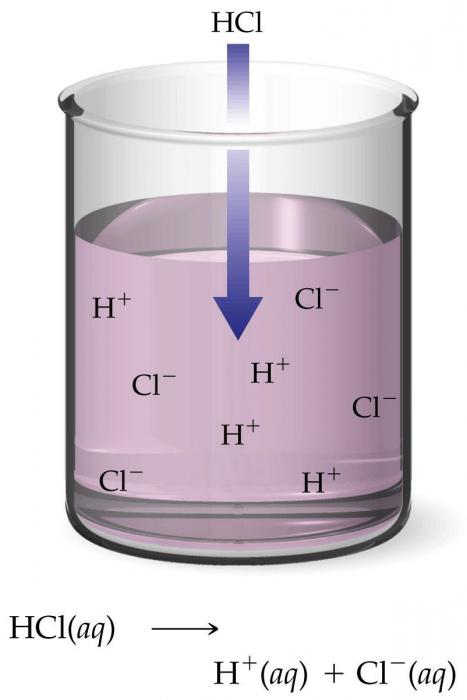
Попадая в раствор или расплав, ионы могут подвергаться действию электрического тока и направленно двигаться к катоду (отрицательному электроду) и аноду (положительному). Последние притягивают противоположно заряженные атомные агрегаты. Отсюда частицы и получили свои названия – катионы и анионы.

Параллельно и одновременно с распадом вещества идёт обратный процесс – ассоциация ионов в исходные молекулы, поэтому стопроцентного растворения вещества не происходит. Такое уравнение реакции электролитической диссоциации содержит знак равенства между правой и левой его частями. Электролитическая диссоциация, как любая другая реакция, подчиняется законам, регулирующим химическое равновесие, не является исключением и закон действующих масс. Он гласит, что скорость процесса распада на ионы пропорциональна концентрации электролита.
Классификация веществ при диссоциации
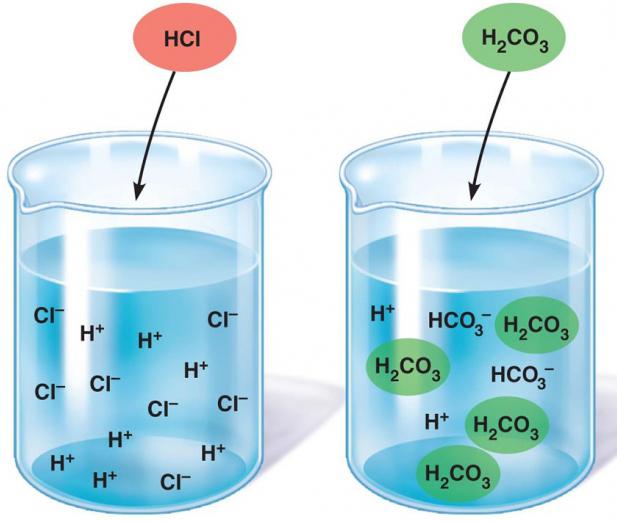
Химическая терминология подразделяет вещества на нерастворимые, малорастворимые и растворимые. Два последних – это слабые и сильные электролиты. Сведения о растворимости тех или иных соединений сведены в таблицу растворимости. Диссоциация сильных электролитов – это необратимый процесс, они нацело распадаются на ионы. Слабые – лишь частично, им присуще явление ассоциации, а следовательно, равновесность происходящих процессов.

Важно отметить, что прямой зависимости между растворимостью и силой электролита нет. У сильных она может быть слабо выражена. Так же как и слабые электролиты могут быть хорошо растворимы в воде.
Примеры соединений, растворы которых проводят электрический ток
К классу «сильные электролиты» относят все хорошо диссоциирующие кислоты, такие как азотная, соляная, бромная, серная, хлорная и другие. В одинаковой степени и щёлочи – гидроокислы щелочных и отдельные представители группы «щелочноземельные металлы». Интенсивна электролитическая диссоциация солей, кроме определённых цианатов и тиоцианатов, а также хлорида ртути (II).
Класс «слабые электролиты» представляют остальные минеральные и почти все органические кислоты: угольная, сульфидная, борная, азотистая, сернистая, кремниевая, уксусная и другие. А также малорастворимые и углеводородные основания и амфотерные гидроксиды (гидроокиси магния, бериллия, железа, цинка в степени окисления (2+)). В свою очередь, молекулы воды являются очень слабыми электролитами, но всё же распадаются на ионы.
Количественное описание диссоциирующих процессов
Степень электролитической диссоциации фактически характеризует масштабы процесса расщепления. Её можно вычислить – число расщепившихся на ионы частиц необходимо разделить на общую численность молекул растворённого вещества в системе. Обозначают эту величину буквой «альфа».
Логично, что для сильных электролитов «α» равна единице, или ста процентам, так как число распавшихся частиц равно общему их количеству. Для слабых – всегда меньше единицы. Полного распада исходных молекул на ионы в водной среде не происходит, и идёт обратный процесс.
Главные факторы, влияющие на полноту распада
На степень электролитической диссоциации влияет ряд неоспоримых факторов. В первую очередь важна природа растворителя и вещества, распадающегося в нём. Например, все сильные электролиты имеют ковалентный сильно полярный или ионный тип связи между составными частицами. Жидкости представлены диполями, в частности вода, в молекулах имеется разделение зарядов, и в результате их специфической ориентации происходит электролитическая диссоциация растворённого вещества.
На значение «альфа» обратно пропорционально влияет концентрация. При её увеличении значение степени диссоциации уменьшается, и наоборот. Сам процесс всецело эндотермический, то есть для его инициации необходимо определённое количество теплоты. Влияние температурного фактора обосновано так: чем он выше, тем больше степень диссоциации.
Второстепенные факторы
Многоосновные кислоты, такие как фосфорная, и основания в составе с несколькими гидроксильными группами, например, Fe(ОН)3, распадаются на ионы ступенчато. Определена зависимость – каждая последующая стадия диссоциации характеризуется степенью, которая в тысячи или десятки тысяч раз меньше предыдущей.
Изменить степень распада может и добавление в систему других электролитов, изменяющих концентрацию одного из ионов основного растворённого вещества. Это влечёт за собой смещение равновесия в сторону, которое определяется правилом Ле Шателье-Брауна – реакция протекает в том направлении, в котором наблюдается нейтрализация влияния, оказанного на систему извне.
Классическая константа равновесного процесса
Для характеристики процесса распада слабого электролита, помимо его степени, применяется константа электролитической диссоциации (Кд), которая выражается отношением концентраций катионов и анионов к количественному содержанию в системе исходных молекул. По сути, она является обычной постоянной химического равновесия для обратимой реакции расщепления растворённого вещества на ионы.
Например, для процесса распада соединения на составляющие его частицы константа диссоциации (Кд) будет определяться частным постоянных концентраций катионов и анионов в составе раствора, возведённых в степени, соответствующие цифрам, стоящим перед ними в химическом уравнении, и общего числа оставшихся не продиссоциировавших формульных единиц растворённого вещества. Прослеживается зависимость – чем выше (Кд), тем больше число катионов и анионов в системе.
Связь концентрации слабого распадающегося соединения, степени диссоциации и константы определяется с помощью закона разведения Оствальда уравнением: Кд = α2с.
Вода как слабо диссоциирующее вещество
Дипольные молекулы в крайне небольшой степени распадаются на заряженные частицы, так как это энергетически невыгодно. Всё же идёт расщепление на катионы водорода и гидроксильные анионы. С учётом гидратационных процессов можно говорить об образовании из двух молекул воды иона гидроксония и ОН(-).
Постоянная диссоциация определяется отношением произведения протонов водорода и гидроксидных групп, называемого ионным произведением воды, к равновесной концентрации не распавшихся молекул в растворе.
Электролитическая диссоциация воды обуславливает наличие в системе Н(+), которые характеризуют её кислотность, а присутствие ОН(-) – основность. Если концентрации протона и гидроксильной группы равны, такая среда называется нейтральной. Существует так называемый водородный показатель – это отрицательный логарифм от общего количественного содержания Н(+) в растворе. рН меньше 7 говорит о том, что среда кислая, больше – о её щелочности. Это очень важная величина, по её экспериментальному значению анализируют биологические, биохимические и химические реакции различных водных систем – озёр, прудов, рек и морей. Неоспорима также актуальность водородного показателя для промышленных процессов.
Запись реакций и обозначения
Уравнение электролитической диссоциации с помощью химических знаков описывает процессы распада молекул на соответствующие частицы и называется ионным. Оно в разы проще стандартного молекулярного и имеет более общий вид.
При составлении такого уравнения нужно учитывать, что вещества, осаждающиеся или удаляющиеся из реагирующей смеси в составе паров газа в ходе реакции, всегда необходимо записывать только в молекулярной форме, в отличие от соединений электролитов, сильные представители которых только в расщепившемся на ионы виде входят в состав растворов. Электролитическая диссоциация для них – необратимый процесс, так как ассоциация невозможна в силу образования не расщепляющихся веществ или газов. Для такого типа уравнения действуют те же правила, что и для прочих химических реакций – суммы коэффициентов левых и правых частей обязательно должны быть равны друг другу для соблюдения материального баланса.
Электролитическая диссоциация кислот и оснований может идти в несколько стадий, если вещества многоосновные или многокислотные. Для каждой подреакции записывается своё уравнение.
Роль в химической науке и её развитии
Величайшее значение создание теории Сванте Аррениуса имело для общего процесса становления физической и, в частности, электрохимической науки. На основе открытия такого явления, как электролитическая диссоциация, интенсивное развитие получили электродные процессы, специфика прохождения токов через различные среды, теория наведения катодно-анодных потенциалов. Кроме этого, значительно продвинулась вперёд теория растворов. Небывалые открытия ждали и химическую кинетику, область коррозии металлов и сплавов, а также работы по поиску новых средств защиты от неё.
В современном мире ещё так много нового и неизвестного. С каждым днём учёные продвигаются всё дальше в познании такой великой дисциплины, как химия. Электролитическая диссоциация, а также её создатели и последователи навсегда заняли почётное место в контексте развития мировой науки.
Похожие статьи
- Теория электролитической диссоциации — одна из основных в химии
- Степень диссоциации, электролиты и положения теории электролитической диссоциации
- Степень и константа гидролиза
- Изотонический коэффициент в растворах электролитов и неэлектролитов
- Гидролиз солей. Какие соли подвергаются гидролизу
- Классификация растворов в химии
- Гидроксид лития. Примеры химических реакции, а также физические свойства щелочи и ее особенности
