Угольная кислота: что нам о ней известно?
Чем больше человек узнает об окружающем его мире, тем больше осознает ограниченность и несовершенство своих знаний. Возьмем, к примеру, газированную воду. Как известно, данный напиток отличается от других тем, что в нем содержится в небольших дозах угольная кислота, которая сразу же начинает распадаться, как только мы открутим пробку на бутылке.

Что такое угольная кислота?
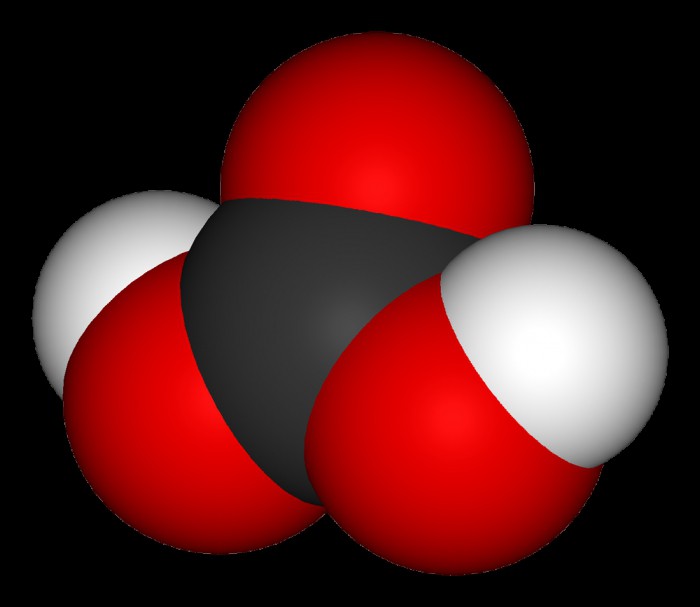
Формула этого химического соединения выглядит довольно просто: Н2СО3. Наличие двух атомов водорода указывает на то, что эта кислота является двухосновной, а ее неустойчивость говорит о ее слабости. Как известно, в воде происходит диссоциация кислот, и рассматриваемое соединение не подпадает под исключение. Впрочем, здесь есть одна особенность: из-за наличия двух оснований данный процесс происходит в два этапа:
H2СО3 ↔ Н+ + НСО3-,
НСО3- ↔ Н+ + СО32-.
При взаимодействии с сильным основанием угольная кислота образовывает нормальные или кислые карбонаты. Последние отличаются тем, что у них замещается не два, а всего лишь один атом водорода. Ярким примером нормального карбоната является стиральная сода (Na2CO3), а роль образца гидрокарбоната может играть пищевая сода (NaHCO3).
Что удалось обнаружить ученым?
При протонировании безводного бикарбоната калия (КНСО3) при температуре -110oC водород выбивает атом К. В результате получается очень чистая угольная кислота. Позже был найден еще более легкий способ – нагрев в вакууме NH4HCO3. В результате такого разложения бикарбоната аммония выделяется аммоний и формируется безводная угольная кислота. Последняя проявляет удивительную стабильность при сублимации в вакууме. Когда ученые начали исследовать данный парадокс, оказалось, что причина кроется в значении энергетического барьера. Для безводного соединения Н2СО3 он составляет 44 ккал/моль, а когда есть вода, его величина оказывается почти в два раза ниже – 24 ккал/моль. Так что при соответствующих условиях угольная кислота вполне может пребывать в свободном виде. Впрочем, данное открытие интересно не только с точки зрения теории химии. Его практическая ценность в том, что оно позволило по-новому изучить процесс дыхания. Теперь ученые считают, что формирование в живом организме угольной кислоты ускоряется при помощи особого фермента, и как раз это и позволяет быстро удалять углекислый газ из клеток сначала в кровь, а затем в легкие.
Похожие статьи
- Магний нитрат: описание, реакция и особенности применения
- Сернистая кислота: что она собой представляет и где применяется?
- Гидрокарбонат натрия: формула, состав, применение
- Карбонат аммония: получение, химические свойства, спектр применения
- Карбонат натрия: свойства, получение, применение
- Ацидоз – это смещение ... Виды, причины, симптомы, диагностика, лечение и профилактика ацидоза
- Мрамор: свойства и применение
