Сернистая кислота: что она собой представляет и где применяется?
При растворении в воде диоксида серы (SO2) получается химическое соединение, известное как сернистая кислота. Формула этого вещества записывается так: H2SO3. По правде говоря, данное соединение является крайне нестабильным, с определенным допущением даже можно утверждать, что его на самом деле не существует. Тем не менее данную формулу часто используют для удобства написания уравнений химических реакций.
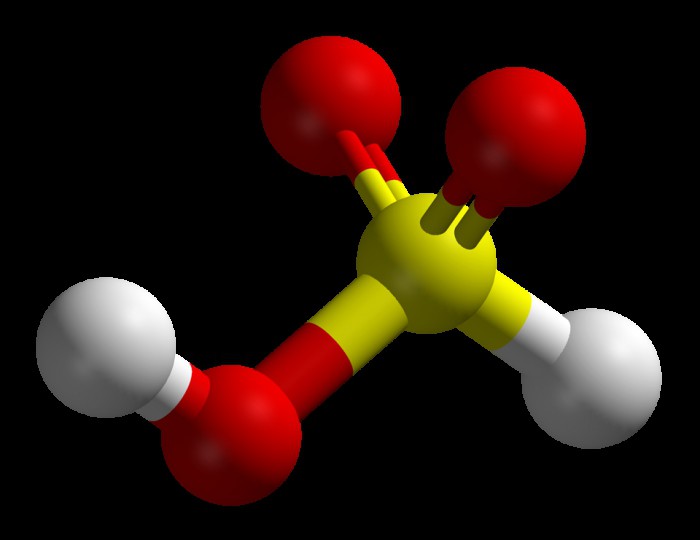
Сернистая кислота: основные свойства
Для водного раствора двуокиси серы характерна кислая среда. Сам он обладает всеми свойствами, которые присущи кислотам, в том числе и реакцией нейтрализации. Сернистая кислота способна образовывать два вида солей: гидросульфиты и обычные сульфиты. Оба относятся к группе восстановителей. Первый вид обычно получается, когда сернистая кислота присутствует в довольно большом количестве: Н2SO3 + KOH -> KHSO3 + Н2O. В противном случае получается обычный сульфит: Н2SO3 + 2КОН -> К2SO3 + 2Н2O. Качественной реакцией на данные соли является их взаимодействие с сильной кислотой. В результате выделяется газ SO2, который легко отличить по характерному резкому запаху.


Где используется сернистая кислота
Получение данного вещества играет большую роль в производстве всевозможных виноматериалов в качестве антисептика, в частности с его помощью удается предотвратить процесс брожения продукта в бочках и тем самым обеспечить его сохранность. Также его применяют для того, чтобы воспрепятствовать ферментации зерна в ходе извлечения из него крахмала. Сернистая кислота и препараты на ее основе обладают широким антимикробным свойством, и поэтому их часто применяют в плодоовощной промышленности при консервировании. Гидросульфит кальция, его еще называют сульфитный щелок, используют для того, чтобы переработать древесину в сульфитную целлюлозу, из которой впоследствии изготавливают бумагу. Осталось добавить, что для человека это соединение является ядовитым, а потому любые лабораторные работы и эксперименты с ним требуют осторожности и повышенного внимания.
Похожие статьи
- Соединения серы: свойства и примеры
- Серная кислота и ее химические свойства
- Физические свойства сероводорода и его применение
- Сильные кислоты и основания: их разнообразие и свойства
- Уксусная кислота: химическая формула, свойства и применение
- Самая сильная кислота. Формула самой сильной кислоты
- Производство вина: технология процесса
