Физические свойства сероводорода и его применение
Среди всех химических соединений, известных в современном мире, можно выделить несколько, о существовании которых знает, пожалуй, даже самый необразованный человек. Почему эти элементы и соединения так популярны? Все просто - они встречаются повсеместно. К таким соединениям относится сероводород.
О соединении
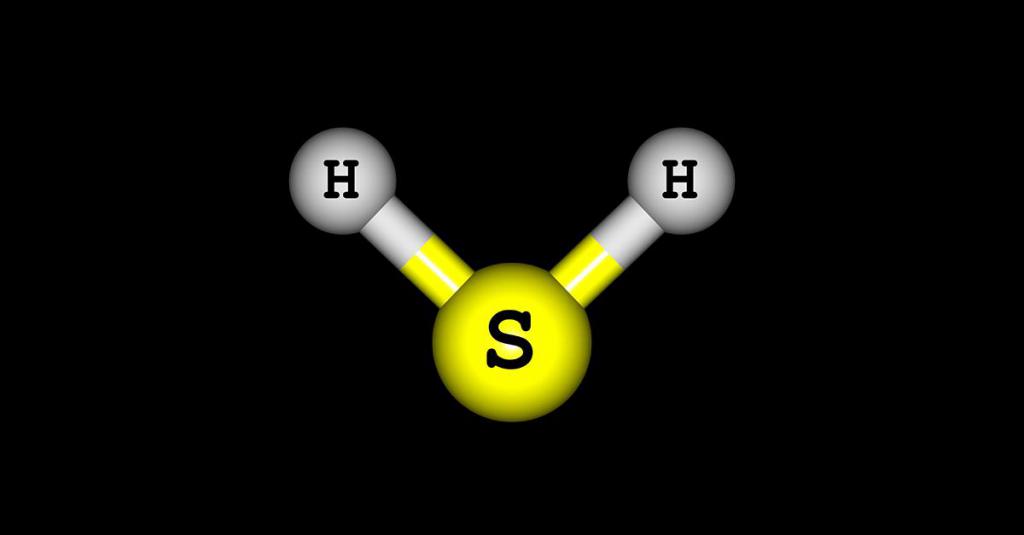
Анализ любого соединения начинаться с изучения его строения. Именно структура определяет физические и химические свойства сероводорода. Молекула этого вещества содержит всего 3 атома: 2 водорода и 1 серу. Связывают составные части ковалентные полярные связи, что обусловлено неметаллической природой соединения. Строение молекулы относится к угловому, что было доказано учеными после непродолжительных исследований. Угол составляет 92 градуса, что незначительно отличается от строения молекулы воды.

Физические свойства
Каждый человек, анализируя новое для себя вещество, в первую очередь обращает свое внимание на его физические свойства: агрегатное состояние, цвет, запах, прочее. Пожалуй, начать следует именно с запаха сероводорода, он известен всем - тухлые яйца. Конечно, назвать его приятным не сможет никто. Каковы физические свойства сероводорода, не смотря на его распространенность, известно только тем, кто работает с ним или прилежно учился в школе. При стандартных условиях вещество имеет газообразную структуру. Описать физические свойства сероводорода, и при этом не упомянуть об изменении его свойств при температуре свыше 20 градусов по Цельсию было бы огромным упущением, ведь именно при этих условиях возможно полное растворение сероводорода водой. Вода, содержащая это соединение, обладает незначительными кислотными свойствами, диссоциация имеет ступенчатый характер.

Для человека вещество достаточно опасно - оно является своего рода ядом, даже в незначительных количествах. Десятая часть процента газа сероводорода может привести к параличу дыхательных путей человека, что приводит к летальному исходу в течении 8 минут (именно такое время мозг способен жить без поступления нового кислорода).
Ядовитые свойства сероводорода распространяются на всех существ, в крови которых содержится гемоглобин. Железо, в большом количестве содержащиеся в эритроцитах, очень легко вступает в реакцию с молекулами сероводорода, образуя сульфид, который не может переносить кислород.
Противоядие к сероводороду очень просто - нужно всего лишь вдохнуть воздух, насыщенный кислородом и имеющий незначительную примесь хлора, который нейтрализует действие серы. Эксперименты и исследования, связанные с сероводородом должны проводится в специальных условиях.
Добыча сероводорода
Реакция получения сероводорода чаще всего проводится при наличии закрытого вытяжного шкафа, что минимизирует возможность получения ученым отравления. При этой реакции чистые водород и сера взаимодействуют между собой, не оставляя каких-либо остаточных продуктов.

Получение сероводорода
В школах для получения сероводорода чаще используют опыт не связанный с риском для здоровья учащихся. Реакция проводится с использованием сульфида железа (II) и раствора одной из кислот - серной или соляной. Для достижения гарантированного результата понадобится пара кусков сульфида размером с обыкновенную горошину. Следующим действием будет заполнение пробирки раствором кислоты вплоть до половины, затем пробирку необходимо закрыть газоотводной трубкой, поместить под вытяжку и нагреть. Если реакция идет, то выделяются мелкие пузырьки газа. Этот метод получения сероводорода эффективен только для получения небольшого количества газа.
Вещество также можно получить при использовании металлического железа и кристаллической серы. Получившийся в ходе реакции сульфид, для полного приобретения физических свойств сероводорода, необходимо смешать с серной кислотой.
Химические свойства
Сероводород реагирует с кислородом, пламя при горении сероводорода приобретает голубой оттенок. При полном сгорании продукта формируется оксид серы и вода. Полученный оксид растворяется в воде, при этом раствор приобретает слабые кислотные свойства. Индикатором этого процесса является лакмусовая бумага, которая окрашивается при соприкосновением с веществом в синий цвет. Таким образом принято получать серу в промышленных масштабах.
При взаимодействии с галогенами и солями проявляются достаточно сильные восстановительные способности вещества, что относится как к химическим, так и к физическим свойствам. В лабораторных условиях для проведения опыта и наблюдения за реакцией взаимодействия сероводорода с галогенами применяют бром и хлор. Продуктом этой реакции станет кристаллическая сера.
Реакция воды и сероводорода приводит к образованию катиона гидроксида. Ко всему прочему соединение имеет способность формировать другие вещества - сульфиды и гидросульфиды. Соединения щелочноземельных и просто щелочных металлов реагируют с сероводородом с образованием бесцветных веществ, в то же время реакция с тяжелыми металлами провоцирует появление вещества черного цвета.
Применение
Сера - одно из первых веществ, чье свойство воспламеняется было обнаружено. Вещество, кроме всего прочего, добавляют в обыкновенный природный газ, который есть на каждой кухне. Физические свойства сероводорода и его применение достаточно обширны, именно поэтому об этом веществе слышали многие. Сероводород ранее применялся в качестве яда для насекомых и вредителей, но был изъят из производства из за множества случаев отравления людей. Из-за токсичности соединения обращаться с ним следует крайне осторожно.

В природе вещество встречается достаточно часто. Оно является результатом продуктов гниения тел различных животных, газ часто встречается в растворенном виде в природных водоемах. Описать все физические свойства сероводорода достаточно сложно, так как их очень много. Выше были описаны основные из них. Применение сероводорода в промышленности также весьма обширно. Некоторые химические опыты и промышленные процессы требуют его присутствия.
Похожие статьи
- Влияние сероводорода на организм человека и животных
- Сернистый газ — физические свойства, получение и применение
- Сернистая кислота: что она собой представляет и где применяется?
- Химические свойства цинка и его соединений
- Бромная вода: ее свойства и особенности
- Химические свойства водорода: особенности и применение
- Аномальные свойства воды: причины, значение
