Планетарная модель атома: опыт Резерфорда
Планетарную модель атома предложил Э. Резерфорд в 1910 году. Первые исследования структуры атома были сделаны им при помощи альфа-частиц. На основе результатов, полученных в экспериментах по их рассеянию, Резерфорд предположил, что весь положительный заряд атома сосредоточен в крошечном ядре в его центре. С другой стороны, отрицательно заряженные электроны распределены внутри всего остального его объема.
Немного предыстории
Первую гениальную догадку о существовании атомов сделал древнегреческий ученый Демокрит. С тех пор идея о существовании атомов, комбинации которых дают все окружающие нас вещества, не покидала воображения людей науки. Периодически к ней обращались различные ее представители, но до начала XIX века их построения были всего лишь гипотезами, не подкрепленными опытными данными.
Наконец, в 1804 году, более чем за сто лет до того как появилась планетарная модель атома, английский ученый Джон Дальтон представил доказательства его существования и ввел понятие атомного веса, явившееся его первой количественной характеристикой. Как и его предшественники, он представлял атомы мельчайшими частями материи, похожими на твердые шарики, которые не могут быть разделены на еще более мелкие частицы.
Открытие электрона и первая модель атома
Прошло почти целое столетие, когда, наконец, в конце XIX века также англичанин Дж. Дж. Томсон открыл первую субатомную частицу, отрицательно заряженный электрон. Поскольку атомы электрически нейтральны, Томсон думал, что они должны состоять из положительно заряженного ядра с электронами, разбросанными по его объему. Основываясь на различных результатах, полученных экспериментально, он в 1898 году предложил свою модель атома, иногда называемую «сливы в пудинге», потому что атом в ней представлялся в виде сферы, заполненной некоторой положительно заряженной жидкостью, в которую электроны были внедрены, как «сливы в пудинг». Радиус такой сферической модели был около 10-8 см. Общий положительный заряд жидкости симметрично и равномерно сбалансирован отрицательными зарядами электронов, как показано на рисунке ниже.

Эта модель удовлетворительно объясняла то обстоятельство, что при нагревании вещества оно начинает излучать свет. Хотя это была первая попытка понимания того, что же такое атом, она не смогла удовлетворить результатам экспериментов, выполненных позже Резерфордом и другими. Томсон в 1911 году согласился, что его модель просто не может ответить, как и почему происходит наблюдаемое в опытах рассеяние α-лучей. Поэтому она была оставлена, а на смену ей пришла более совершенная планетарная модель атома.
Как же все таки устроен атом?
Эрнест Резерфорд дал объяснение явления радиоактивности, которое принесло ему Нобелевскую премию, однако его наиболее значительный вклад в науку был сделан позднее, когда он установил, что атом состоит из плотного ядра, окруженного орбитами электронов, подобно тому, как Солнце окружено орбитами планет.
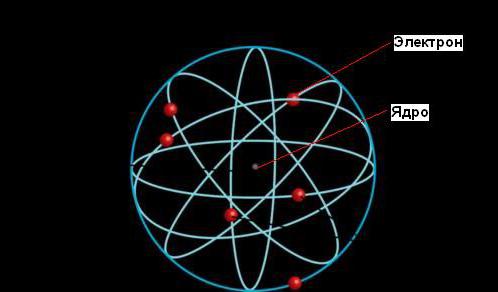
Согласно планетарной модели атома, большая часть его массы сконцентрирована в крошечном (по сравнению с размерами всего атома) ядре. Электроны двигаются вокруг ядра, путешествуя с невероятной скоростью, но большая часть объема атомов является при этом пустым пространством.
Размер ядра настолько мал, что его диаметр в 100 000 раз меньше, чем у атома. Диаметр ядра была оценен Резерфордом как 10-13 см, в отличие от размера атома - 10-8 см. За пределами ядра электроны вращаются вокруг него с высокими скоростями, в результате чего возникают центробежные силы, уравновешивающие электростатические силы притяжения между протонами и электронами.
Опыты Резерфорда
Планетарная модель атома возникла в 1911, после знаменитого эксперимента с золотой фольгой, позволившего получить некоторые фундаментальные сведения о его строении. Путь Резерфорда к открытию атомного ядра является хорошим примером роли творчества в науке. Его поиски начались еще в 1899 году, когда он обнаружил, что некоторые элементы испускают положительно заряженные частицы, которые могут проникать через что угодно. Он назвал эти частицы альфа (α) частицами (теперь мы знаем, что они были ядрами гелия). Как и все хорошие ученые, Резерфорд был любопытен. Он задавался вопросом, можно ли использовать альфа-частицы, чтобы узнать структуру атома. Резерфорд решил нацелить луч альфа-частиц на лист очень тонкой золотой фольги. Он выбрал золото, потому что из него можно получать листы толщиной всего 0,00004 см. За листом золотой фольги он поставил экран, который светился, когда альфа-частицы ударяли в него. Его использовали для обнаружения альфа-частиц после их прохождения через фольгу. Небольшая прорезь в экране позволяла лучу альфа-частиц достичь фольги после выхода из источника. Часть из них должна пройти сквозь фольгу и продолжать двигаться в том же направлении, другая их часть должна отскакивать от фольги и отражаться под острыми углами. Вы можете увидеть схему эксперимента на рисунке ниже.
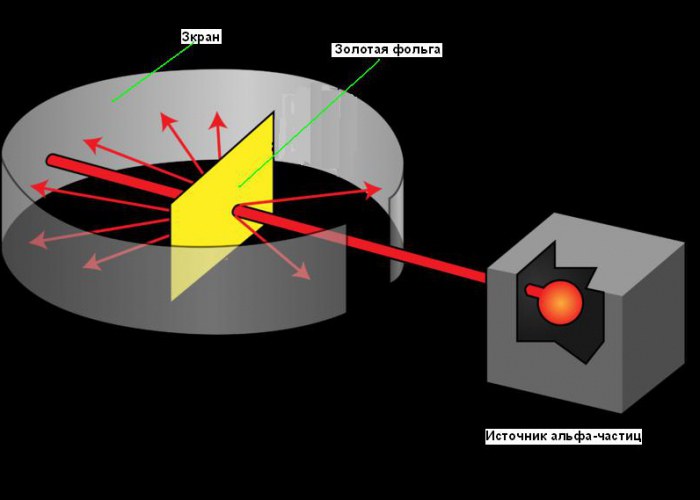
Что же получилось в опыте Резерфорда?
Исходя из модели атома Дж. Дж. Томсона, Резерфорд предполагал, что сплошные области положительного заряда, заполняющие весь объем золотых атомов, будут отклонять или сгибать траектории всех альфа-частиц, когда они проходят через фольгу.
Однако подавляющее большинство альфа-частиц прошло прямо через золотую фольгу, как будто ее и не было. Казалось, они проходят через пустое пространство. Лишь немногие из них отклоняются от прямого пути, как и предполагалось вначале. Ниже приведен график зависимости количества частиц, рассеянных в соответствующем направлении, от угла рассеяния.
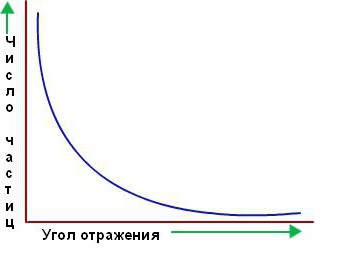
Удивительно, но крошечный процент частиц возвращался от фольги, как баскетбольный мяч отскакивает от щита. Резерфорд понял, что эти отклонения были результатом прямого столкновения между альфа-частицами и положительно заряженными компонентами атома.
Ядро занимает центральное место
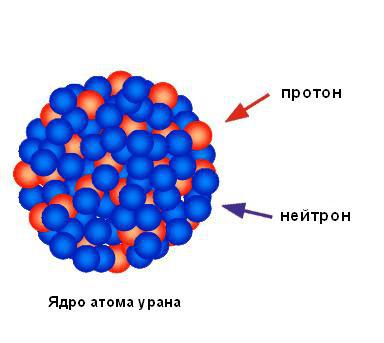
Исходя из ничтожного процента отразившихся от фольги альфа-частиц, можно сделать вывод, что весь положительный заряд и практически вся масса атома сосредоточены в одной маленькой области, а в остальной части атома в основном находится пустое пространство. Резерфорд назвал площадь концентрированного положительного заряда ядром. Он предсказал и вскоре обнаружил, что оно содержит положительно заряженные частицы, которые он назвал протонами. Резерфорд предсказал существование нейтральных атомных частиц, называемых нейтронами, но он не смог обнаружить их. Тем не менее его ученик Джеймс Чедвик открыл их через несколько лет. На рисунке ниже показана структура ядра атома урана.
Атомы состоят из положительно заряженных тяжелых ядер, окруженных вращающимися вокруг них отрицательно заряженными чрезвычайно легкими частицами-электронами, причем на таких скоростях, что механические центробежные силы просто балансируют их электростатическое притяжение к ядру, и в этой связи якобы обеспечивается стабильность атома.
Недостатки этой модели
Основная идея Резерфорда относилась к идее малоразмерного атомного ядра. Предположение об орбитах электронов было чистой гипотезой. Он не знал точно, где и как электроны вращаются вокруг ядра. Поэтому планетарная модель Резерфорда не объясняет распределение электронов на орбитах.
Основная идея Резерфорда относилась к идее малоразмерного атомного ядра. Предположение об орбитах электронов было чистой гипотезой. Он не знал точно, где и как электроны вращаются вокруг ядра. Поэтому планетарная модель Резерфорда не объясняет распределение электронов на орбитах.
Кроме того, стабильность атома Резерфорда была возможна только при непрерывном движении электронов по орбитам без потерь кинетической энергии. Но электродинамические расчеты показали, что движение электронов по любым криволинейным траекториям, сопровождающееся изменением направления вектора скорости и появлением соответствующего ускорения, неизбежно сопровождается излучением электромагнитной энергии. При этом, согласно закону сохранения энергии, кинетическая энергия электрона должна очень быстро израсходоваться на излучение, и он должен упасть на ядро, как схематически показано на рисунке ниже.
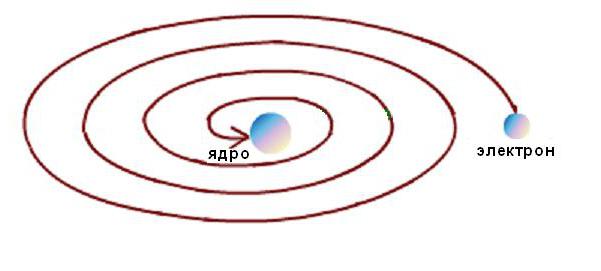
От Резерфорда к Нильсу Бору
Следующий крупный шаг вперед в атомной истории произошел в 1913 году, когда датский ученый Нильс Бор опубликовал описание более детальной модели атома. Она определяла более четко места, где могут находиться электроны. Хотя позже ученые будут развивать и более изысканные атомные конструкции, но планетарная модель атома Бора была в основном правильной, и многое из нее принимается до сих пор. Она имела множество полезных приложений, например с ее помощью объясняют свойства различных химических элементов, характер спектра их излучений и строение атома. Планетарная модель и модель Бора явились важнейшими вехами, обозначившими появление нового направления в физике – физики микромира. Бор получил Нобелевскую премию 1922 по физике за его вклад в наше понимание структуры атома.
Что же нового привнес Бор в модель атома?
Будучи еще молодым человеком, Бор работал в лаборатории Резерфорда в Англии. Поскольку в модели Резерфорда была слабо проработана концепция электронов, Бор сосредоточился именно на них. В результате была существенно доработана планетарная модель атома. Постулаты Бора, которые он сформулировал в своей статье «О строении атомов и молекул», вышедшей в 1913 году, гласят:
1. Электроны могут двигаться вокруг ядра только на фиксированных расстояниях от него, определяемых тем количеством энергии, которое у них есть. Он назвал эти фиксированные уровни энергетическими уровнями или электронными оболочками. Бор представлял их в виде концентрических сфер, с ядром в центре каждой из них. При этом электроны с меньшей энергией будут найдены на более низких уровнях, ближе к ядру. Те же из них, у кого больше энергии, будут найдены на более высоких уровнях, дальше от ядра.
2. Если электрон поглощает некоторое (вполне определенное для данного уровня) количество энергии, то он будет прыгать на следующий, более высокий энергетический уровень. И наоборот, если он потеряет такое же количество энергии, то вернется назад к исходному уровню. Однако электрон не может существовать на двух энергетических уровнях.
Эта идея иллюстрируются рисунком.
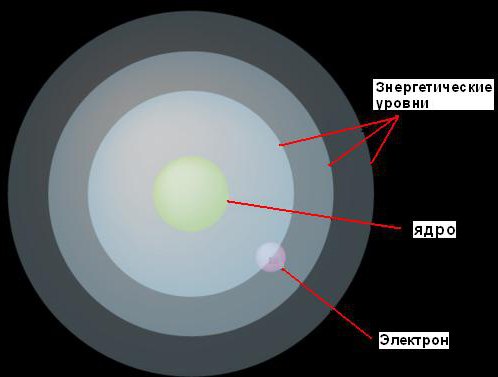
Энергетические порции для электронов
Модель атома Бора на самом деле является сочетанием двух различных идей: атомной модели Резерфорда с электронами, вращающимися вокруг ядра (по сути это планетарная модель атома Бора-Резерфорда), и идеи немецкого ученого Макса Планка о квантовании энергии вещества, опубликованной в 1901 году. A квант (во множественном числе - кванты) является минимальным количеством энергии, которая может быть поглощена или излучена веществом. Он является своего рода шагом дискретизации количества энергии.
Если энергию сравнить с водой и вы хотите добавить ее к материи в виде стакана, вы не можете просто залить воду непрерывной струей. Вместо этого вы можете добавить ее в небольших количествах, например, по чайной ложке. Бор считал, что если электроны могут поглощать или терять только фиксированные количества энергии, то они должны варьировать свою энергию только этими фиксированными количествами. Таким образом, они могут занимать только фиксированные энергетические уровни вокруг ядра, которые соответствуют квантованным приращениям их энергии.
Так из модели Бора вырастает квантовый подход к объяснению, что же из себя представляет строение атома. Планетарная модель и модель Бора явились своеобразными ступенями от классической физики к квантовой, являющейся основным инструментом в физике микромира, включая и атомную физику.
Похожие статьи
- Кто открыл нейтрон, протон и электрон, и какое значение это имело для человечества
- Модель атома Томсона: описание и опровержение
- Строение атома: непростые особенности
- Опыт Резерфорда и революционная атомная модель
- Белые карлики: характеристика, фото
- Что такое атом? Из каких частей он состоит и в чем измеряется его масса?
- Откуда мы знаем, сколько лет Вселенной?
