Идеальный газ и его определение
Наука физика играет значимую роль в изучении окружающего мира. Поэтому ее понятия и законы начинают проходить еще в школе. Свойства вещества измеряются в разных аспектах. Если рассматривать его агрегатное состояние, то здесь существует особая методика. Идеальный газ - это физическая концепция, которая позволяет оценить свойства и характеристики материала, из которого состоит весь наш мир.
Общее определение
Идеальным газом названа модель, в которой взаимодействием между молекулами принято пренебрегать. Процесс взаимодействия частиц любого вещества друг с другом довольно сложный.

Когда газ можно считать идеальным
Существует несколько факторов, благодаря которым газ называется идеальным. Первым признаком является поведение молекул как абсолютно упругих тел, между ними отсутствуют силы притяжения. При этом газ будет очень разряжен. Расстояние между мельчайшими составляющими вещества будет гораздо больше размеров их самих. В таком случае тепловое равновесие будет достигаться мгновенно по всему объему. Чтобы достичь положения идеального газа в лабораторных условиях, реальный его тип разрежается соответствующим образом. Некоторые вещества в газообразном состоянии даже при комнатной температуре и нормальном атмосферном давлении практически не отличаются от идеального состояния.
Границы применения модели
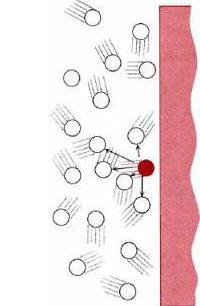
Иеальный газ рассматривается в зависимости от поставленных задач. Если перед исследователем поставлена задача определить зависимость между температурой, объемом и давлением, то идеальным можно считать такое состояние вещества, при котором у газа наблюдается высокая точность до давлений, измеряемых несколькими десятками атмосфер. Но в случае изучения фазового перехода, например, испарения и конденсации, процесса достижения равновесия в газе, рассматриваемую модель нельзя применять даже при очень маленьком давлении. Давление газа на стенку пробирки происходит при хаотическом ударении молекул о стекло. Когда такие удары часты, организм человека может уловить эти изменения как непрерывное воздействие.
Уравнение идеального газа
Основываясь на главных принципах молекулярно-кинетической теории, было выведено главное уравнение идеального газа.
Температура
Вычислив только давление газа на стенки сосуда, нельзя определить средний показатель кинетической энергии его частиц.
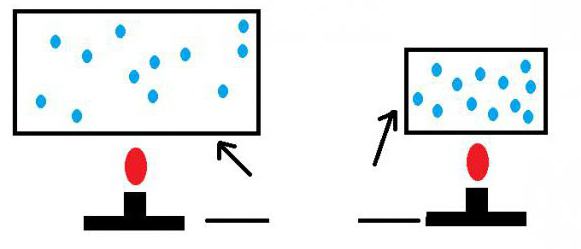
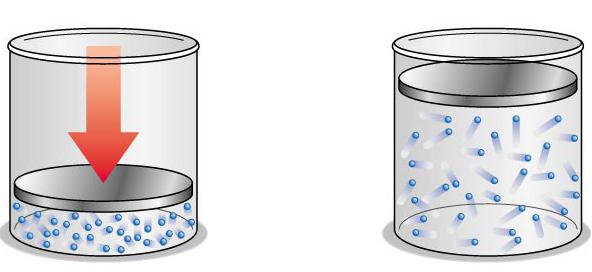
Причем этого нельзя сделать ни для отдельной молекулы, ни для их концентрации. Поэтому для измерения параметров газа необходимо определять еще одну величину. Ею выступает температура, которая также связана с кинетической энергией молекул. Такой показатель выступает скалярной физической величиной. Температура описывает термодинамическое равновесие. В таком состоянии не происходит изменение параметров на микроуровне. Температура измеряется как отклонение от нулевого значения. Она характеризует насыщенность хаотического движения наименьших частиц газа. Она измеряется средним значением их кинетической энергии. Определяется этот показатель при помощи термометров в градусах различных отметок. Существует термодинамическая абсолютная шкала (Кельвина) и эмпирические ее разновидности. Они отличаются начальными точками.
Уравнение положения идеального газа с учетом температуры
Физик Больцман утверждает, что средний показатель кинетической энергии частицы пропорционален абсолютному показателю температуры. Ек = 3/2 кТ, где к = 1,38∙10-23, Т - температура. Работа идеального газа будет равна: Р = NkT/V, где N - количество молекул, V - объем сосуда. Если к этому показателю добавить концентрацию n = N/V, то вышеприведенная формула будет иметь такой вид: p = nkT. Эти два уравнения имеют различные формы записи, но они связывают для идеального газа давление, объем и температуру. Эти вычисления можно применять как к чистым газам, так и к их смесям. В последнем варианте под n нужно понимать все число молекул веществ, их суммарную концентрацию или полное количество молей в веществе.
Три газовых закона
Идеальный газ и его частные законы были открыты экспериментально и лишь потом подтверждены теоретически.
Абсолютная шкала измерения
В абсолютной шкале измерения принято единицей называть Кельвин. Она выбрана исходя из популярной шкалы Цельсия. Один Кельвин соответствует одному градусу по Цельсию. Но в шкале абсолютной за ноль принято значение, при котором давление идеального газа при постоянном объеме будет равно нулю.

Изучив такое понятие, как идеальный газ, можно понять принцип работы любого вещества. Расширив знания в этой области, можно понять свойства и поведение любого газообразного вещества.
Похожие статьи
- Физика: давление твердых тел, жидкостей и газов
- Что такое абсолютный ноль и можно ли его достичь
- Закон Клапейрона-Менделеева: формула, формулировка, использование
- Законы термодинамики и их описание
- Цикл Карно. Газ, совершающий цикл Карно
- Газгольдер - что это такое и в чем его назначение? Газгольдер для отопления дома
- Самый легкий газ в мире и его характеристики
