Классификация термодинамических систем
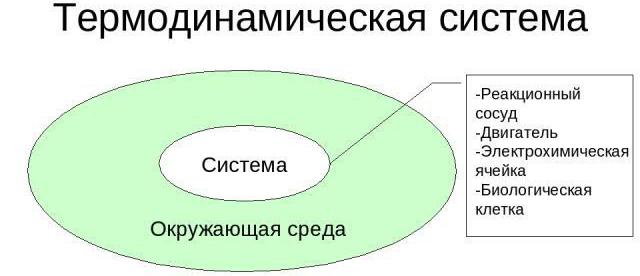
Рассмотрим особенности термодинамических систем. Под ними принято понимать физические макроскопические формы, состоящие из значительного количества частиц, которые не предполагают использования для описания макроскопических показателей каждой отдельной частицы.
Нет ограничений в природе материальных частиц, которые являются составными компонентами таких систем. Они могут быть представлены в виде молекул, атомов, ионов, электронов, фотонов.
Особенности
Проанализируем отличительные характеристики термодинамических систем. В качестве примера можно привести любой предмет, который можно наблюдать без использования телескопов, микроскопов. Чтобы дать полноценное описание такой системе, подбирают макроскопические детали, благодаря которым можно определить объем, давление, температуру, электрическую поляризацию, величину магнитной индукции, химический состав, массу компонентов.
Для любых термодинамических систем существуют условные либо реальные границы, которые отделяют их от окружающей среды. Вместо нее часто используют понятие термостата, характеризующегося такой высокой величиной теплоемкости, что в случае теплообмена с анализируемой системой температурный показатель сохраняет неизменное значение.
Классификация систем
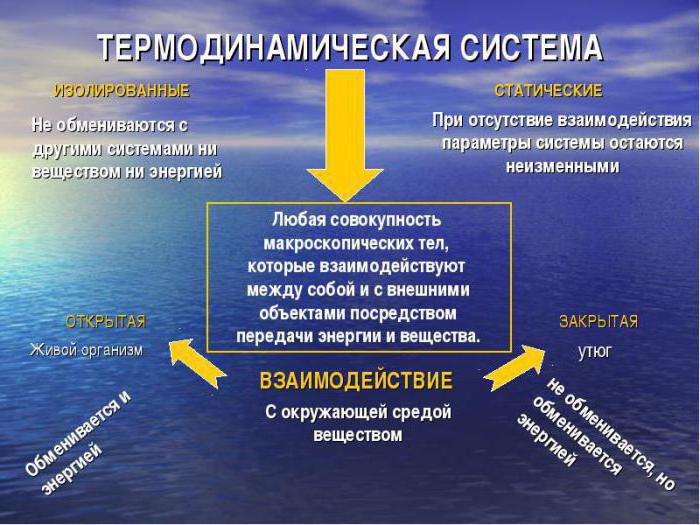
Рассмотрим, что представляет собой классификация термодинамических систем. В зависимости от характера взаимодействия ее с окружающей средой, принято выделять:
- изолированные виды, которые не обмениваются ни веществом, ни энергией с внешней средой;
- адиабатически изолированные, не совершающие обмена с внешней средой веществом, но вступающие в обмен работой или энергией;
- у закрытых термодинамических систем нет обмена веществом, допускается только изменение величины энергии;
- открытые системы характеризуются полной передачей энергии, вещества;
- частично открытые могут иметь полупроницаемые перегородки, поэтому не в полной мере принимать участие в материальном обмене.
В зависимости от описания, параметры термодинамической системы, могут подразделяться на сложные и простые варианты.

Особенности простых систем
Простыми системами называют равновесные состояния, определить физическое состояние которых можно удельным объемом, температурой, давлением. Примеры термодинамических систем подобного типа – изотропные тела, имеющие равные характеристики в разных направлениях и точках. Так, жидкости, газообразные вещества, твердые тела, которые находятся в состоянии термодинамического равновесия, не подвергаются воздействию электромагнитных и гравитационных сил, поверхностному натяжению, химическим превращениям. Анализ простых тел признан в термодинамике важным и актуальным с практической и теоретической точки зрения.
Внутренняя энергия термодинамической системы такого вида связана с окружающим миром. При описании используют число частиц, массу вещества каждого отдельного компонента.
Сложные системы
К сложным относят термодинамические системы, которые не попадают под простые виды. Например, ими являются магнетики, диэлектрики, твердые упругие тела, сверхпроводники, поверхности раздела фаз, тепловое излучение, электрохимические системы. В качестве параметров, используемых для их описания, отметим упругость пружины или стержня, поверхность фазового раздела, тепловое излучение.
Физической системой называют такую совокупность, в которой нет химического взаимодействия между веществами в пределах показателей температуры, давления, выбранных для исследования. А химическими системами называют те варианты, которые подразумевают взаимодействие между ее отдельными компонентами.
Внутренняя энергия термодинамической системы зависит от наличия изоляции ее с окружающим миром. Например, в качестве варианта адиабатической оболочки, можно представить сосуд Дьюара. Гомогенный характер проявляется у системы, в которой все компоненты имеют сходные свойства. Примерами их служат газовые, твердые, жидкие растворы. Типичным примером газовой гомогенной фазы является атмосфера Земли.
Особенности термодинамики
Данный раздел науки занимается изучением основных закономерностей протекания процессов, которые связаны с выделением, поглощением энергии. В химической термодинамике предполагается изучение взаимных превращений составных частей системы, установление закономерностей перехода одного вида энергии в другой при заданных условиях (давлении, температуре, объеме).
Система, являющаяся объектом термодинамического исследования, может быть представлена в виде любого объекта природы, включающего в себя большое число молекул, которые отделены границей раздела с другими реальными объектами. Под состоянием системы подразумевают совокупность ее свойств, которые позволяют определять ее с позиций термодинамики.
Заключение
В любой системе наблюдается переход одного вида энергии в другой, устанавливается термодинамическое равновесие. Раздел физики, которые занимается детальным изучением превращений, изменений, сохранений энергии, имеет особое значение. Например, в химической кинетике можно не просто описать состояние системы, но и рассчитать условия, способствующие ее смещению в нужном направлении.
Закон Гесса, связывающий энтальпию, энтропию рассматриваемого превращения, дает возможность выявлять возможность самопроизвольного протекания реакции, рассчитывать количество теплоты, выделяемого (поглощаемого) термодинамической системой.
Термохимия, базирующаяся на основах термодинамики, имеет практическое значение. Благодаря данному разделу химии, на производстве проводят предварительные расчеты эффективности топлива и целесообразности внедрения определенных технологий в реальное производство. Сведения, получаемые из термодинамики, дают возможность применять явления упругости, термоэлектричества, вязкости, намагничивания для промышленного производства различных материалов.
Похожие статьи
- Энергия Гиббса и ее использование для описания возможности протекания процессов
- Первое начало термодинамики -объяснение этого закона и практические примеры.
- Тепловой насос: принцип работы для отопления дома
- Что такое турбина? Виды турбин. Устройство и принцип действия турбины
- Производственные системы: виды, характеристики и внедрение. Современное производство
- Метод валентных связей и его основные положения
- Что такое горение? Значение слова, суть химического процесса
