20 аминокислот: названия, формулы, значение. Аланин, валин, серин, лизин, пролин, тирозин
Химические вещества, содержащие структурные компоненты молекулы карбоновой кислоты и амина, называются аминокислотами. Это общее название группы органических соединений, в составе которых присутствует углеводородная цепь, карбоксильная группа (-СООН) и аминогруппа (-NH2). Их предшественниками являются карбоновые кислоты, а молекулы, у которых водород у первого углеродного атома замещен аминогруппой, называются альфа-аминокислотами.
Всего 20 аминокислот имеют ценность для ферментативных реакций биосинтеза, протекающих в организме всех живых существ. Эти вещества называются стандартными аминокислотами. Существуют также нестандартные аминокислоты, которые включены в состав некоторых специальных белковых молекул. Они не встречаются повсеместно, хотя выполняют важную функцию в живой природе. Вероятно, радикалы этих кислот модифицируются уже после биосинтеза.
Общая информация и список веществ
Известны две большие группы аминокислот, которые были выделены по причине закономерностей их нахождения в природе. В частности, существуют 20 аминокислот стандартного типа и 26 нестандартных аминокислот. Первые находят в составе белков любого живого организма, тогда как вторые являются специфическими для отдельных живых организмов.
20 аминокислот стандартных делятся на 2 типа в зависимости от способности синтезироваться в человеческом организме. Это заменимые, которые в клетках человека способны образовываться из предшественников, и незаменимые, для синтеза которых не существует ферментных систем или субстрата. Заменимые аминокислоты могут не присутствовать в пище, так как их организм может синтезировать, восполняя их количество при необходимости. Незаменимые аминокислоты не могут быть получены организмом самостоятельно, а поэтому должны поступать с пищей.
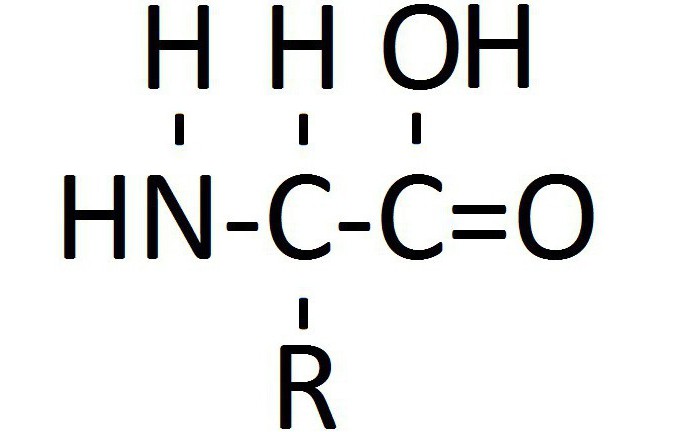
Биохимиками определены названия аминокислот из группы незаменимых. Всего их известно 8:
- метионин;
- треонин;
- изолейцин;
- лейцин;
- фенилаланин;
- триптофан;
- валин;
- лизин;
- также часто сюда относят гистидин.
Это вещества с различным строением углеводородного радикала, но обязательно с наличием карбоксильной группы и аминогруппы у альфа-С-атома.
В группе заменимых аминокислот присутствует 11 веществ:
- аланин;
- глицин;
- аргинин;
- аспарагин;
- кислота аспарагиновая;
- цистеин;
- кислота глютаминовая;
- глютамин;
- пролин;
- серин;
- тирозин.
В основном их химическое строение проще, нежели у незаменимых, поэтому их синтез дается организму легче. Большинство незаменимых аминокислот невозможно получить только из-за отсутствия субстрата, то есть молекулы-предшественника путем реакции переаминирования.
Глицин, аланин, валин
В биосинтезе белковых молекул наиболее часто используется глицин, валин и аланин, (формула каждого вещества указана ниже на рисунке). Эти аминокислоты самые простые по химической структуре. Вещество глицин и вовсе является простейшим в классе аминокислот, то есть помимо альфа-углеродного атома соединение не имеет радикалов. Однако даже простейшая по структуре молекула играет важную роль в обеспечении жизнедеятельности. В частности, из глицина синтезируется порфириновое кольцо гемоглобина, пуриновые основания. Порфировое кольцо — это белковый участок гемоглобина, призванный удерживать атомы железа в составе целостного вещества.
Глицин участвует в обеспечении жизнедеятельности головного мозга, выступая тормозным медиатором ЦНС. Это означает, что он в большей степени участвует в работе коры головного мозга — его наиболее сложно организованной ткани. Что важнее, глицин является субстратом для синтеза пуриновых оснований, нужных для образования нуклеотидов, которые кодируют наследственную информацию. Вдобавок глицин служит источником для синтеза других 20 аминокислот, тогда как сам может быть образован из серина.
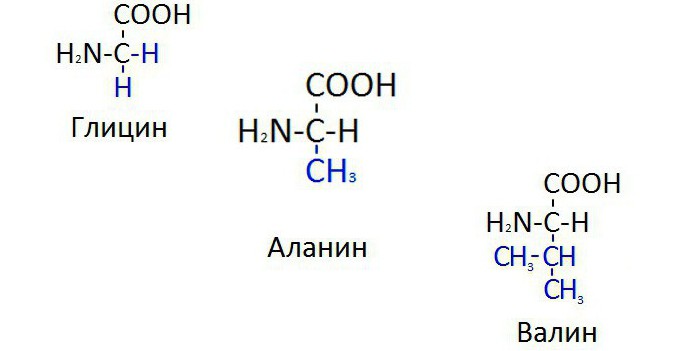
У аминокислоты аланин формула немногим сложнее, чем у глицина, так как она имеет метильный радикал, замененный на один атом водорода у альфа-углеродного атома вещества. При этом аланин также остается одной из самых часто вовлекаемых в процессы биосинтеза белков молекулой. Она входит в состав любого белка в живой природе.
Неспособный синтезироваться в организме человека валин — аминокислота с разветвленной углеводородной цепочкой, состоящей из трех углеродных атомов. Изопропиловый радикал придает молекуле больший вес, однако из-за этого невозможно найти субстрат для биосинтеза в клетках человеческих органов. Поэтому валин должен обязательно поступать с пищей. Он присутствует преимущественно в структурных белках мышц.
Результаты исследований подтверждают, что валин необходим для функционирования центральной нервной системы. В частности, за счет его способности восстанавливать миелиновую оболочку нервных волокон он может использоваться в качестве вспомогательного средства при лечении рассеянного склероза, наркоманий, депрессий. В большом количестве содержится в мясных продуктах, рисе, сушеном горохе.
Тирозин, гистидин, триптофан
В организме тирозин способен синтезироваться из фенилаланина, хотя в большом количестве поступает с молочной пищей, преимущественно с творогом и сырами. Входит в состав казеина - животного белка, в избытке содержащемся в творожных и сырных продуктах. Ключевое значение тирозина в том, что его молекула становится субстратом синтеза катехоламинов. Это адреналин, норадреналин, дофамин - медиаторы гуморальной системы регуляции функций организма. Тирозин способен быстро проникать и через гематоэнцефалический барьер, где быстро превращается в дофамин. Молекула тирозина участвует в меланиновом синтезе, обеспечивая пигментацию кожи, волос и радужки глаза.
Аминокислота гистидин входит в состав структурных и ферментных белков организма, является субстратом синтеза гистамина. Последний регулирует желудочную секрецию, участвует в иммунных реакциях, регулирует заживление повреждений. Гистидин является незаменимой аминокислотой, и организм восполняет ее запасы только из пищи.
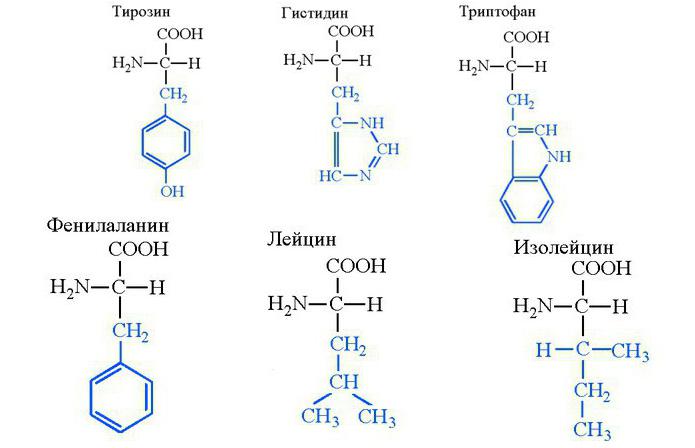
Триптофан так же неспособен синтезироваться организмом из-за сложности своей углеводородной цепочки. Он входит в состав белков и является субстратом синтеза серотонина. Последний является медиатором нервной системы, призванным регулировать циклы бодрствования и сна. Триптофан и тирозин - эти названия аминокислот следует помнить нейрофизиологам, так как из них синтезируются главные медиаторы лимбической системы (серотонин и дофамин), обеспечивающие наличие эмоций. При этом не существует молекулярной формы, обеспечивающей накопление незаменимых аминокислот в тканях, из-за чего они должны присутствовать в пище ежедневно. Белковая еда в количестве 70 граммов в сутки полностью обеспечивает эти потребности организма.
Фенилаланин, лейцин и изолейцин
Фенилаланин примечателен тем, что из него синтезируется аминокислота тирозин при ее недостатке. Сам фенилаланин является структурным компонентом всех белков в живой природе. Это метаболический предшественник нейромедиатора фенилэтиламина, обеспечивающий ментальную концентрацию, подъем настроения и психостимуляцию. В РФ в концентрации свыше 15% оборот данного вещества запрещен. Эффект фенилэтиламина схожий с таковым у амфетамина, однако первый не отличается пагубным воздействием на организм и отличается лишь развитием психической зависимости.
Одно из главных веществ группы аминокислот — лейцин, из которого синтезируются пептидные цепи любого белка человека, включая ферменты. Соединение, применяемое в чистом виде, способно регулировать функции печени, ускорять регенерацию ее клеток, обеспечивать омоложение организма. Поэтому лейцин — аминокислота, которая выпускается в виде лекарственного препарата. Она отличается высокой эффективностью в ходе вспомогательного лечения цирроза печени, анемии, лейкоза. Лейцин — аминокислота, существенно облегчающая реабилитацию пациентов после химиотерапии.

Изолейцин, как и лейцин, не способен синтезироваться организмом самостоятельно и относится к группе незаменимых. Однако это вещество не является лекарственным средством, так как организм испытывает в нем небольшую потребность. В основном в биосинтезе участвует только один его стереоизомер (2S,3S)-2-амино-3-метилпентановая кислота.
Пролин, серин, цистеин
Вещество пролин — аминокислота с циклическим углеводородным радикалом. Ее основная ценность в наличии кетонной группы цепочки, из-за чего вещество активно используется в синтезе структурных белков. Восстановление кетона гетероцикла до гидроксильной группы с образованием гидроксипролина формирует множественные водородные связи между цепочками коллагена. В результате нити этого белка сплетаются между собой и обеспечивают прочную межмолекулярную структуру.
Пролин — аминокислота, обеспечивающая механическую прочность тканей человека и его скелета. Наиболее часто она находится в коллагене, входящем в состав костей, хряща и соединительной ткани. Как и пролин, цистеин является аминокислотой, из которой синтезируется структурный белок. Однако это не коллаген, а группа веществ альфа-кератинов. Они образуют роговой слой кожи, ногти, имеются в составе чешуек волос.
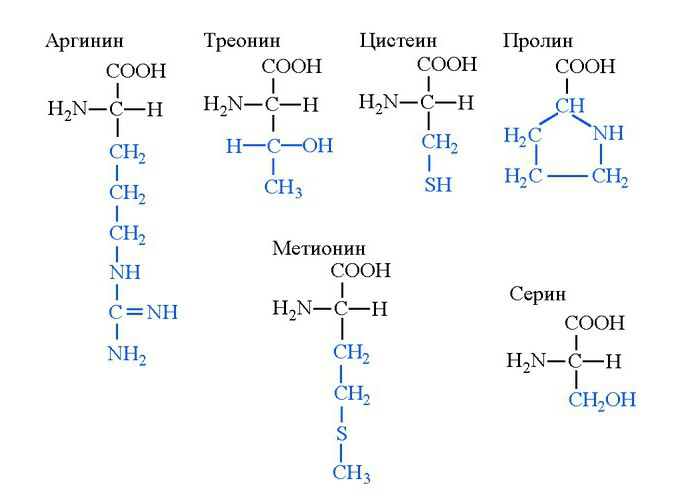
Вещество серин — аминокислота, существующая в виде оптических L и D-изомеров. Это заменимое вещество, синтезируемое из фосфоглицерата. Серин способен образовываться в ходе ферментативной реакции из глицина. Данное взаимодействие обратимое, а поэтому глицин может образовываться из серина. Основная ценность последнего в том, что из серина синтезируются ферментативные белки, точнее их активные центры. Широко серин присутствует в составе структурных белков.
Аргинин, метионин, треонин
Биохимиками определено, что избыточное потребление аргинина провоцирует развитие заболевания Альцгеймера. Однако помимо негативного значения у вещества присутствуют и жизненно-важные для размножения функции. В частности, за счет наличия гуанидиновой группы, пребывающей в клетке в катионной форме, соединение способно образовывать огромное количество водородных межмолекулярных связей. Благодаря этому аргинин в виде цвиттер-иона обретает способность связаться с фосфатными участками молекул ДНК. Результатом взаимодействия является образование множества нуклеопротеидов - упаковочной формы ДНК. Аргинин в ходе изменения рН ядерного матрикса клетки может отсоединяться от нуклеопротеида, обеспечивая раскручивание цепи ДНК и начало трансляции для биосинтеза белка.
Аминокислота метионин в своей структуре содержит атом серы, из-за чего чистое вещество в кристаллическом виде имеет неприятный тухлый запах из-за выделяемого сероводорода. В организме человека метионин выполняет регенераторную функцию, способствуя заживлению мембран печеночных клеток. Поэтому выпускается в виде аминокислотного препарата. Из метионина синтезируется и второй препарат, предназначенный для диагностики опухолей. Синтезируется он путем замещения одного углеродного атома на его изотоп С11. В таком виде он активно накапливается в опухолевых клетках, давая возможность определять размеры новообразований головного мозга.
В отличие от указанных выше аминокислот, треонин имеет меньшее значение: аминокислоты из него не синтезируются, а его содержание в тканях невелико. Основная ценность треонина — включение в состав белков. Специфических функций эта аминокислота не имеет.
Аспарагин, лизин, глутамин
Аспарагин — распространенная заменимая аминокислота, присутствующая в виде сладкого на вкус L-изомера и горького D-изомера. Из аспарагина образуются белки организма, а путем глюконеогенеза синтезируется оксалоацетат. Это вещество способно окисляться в цикле трикарбоновых кислот и давать энергию. Это означает, что помимо структурной функции аспарагин выполняет и энергетическую.
Неспособный синтезироваться в организме человека лизин — аминокислота с щелочными свойствами. Из нее в основном синтезируются иммунные белки, ферменты и гормоны. При этом лизин — аминокислота, самостоятельно проявляющая антивирусные средства против вируса герпеса. Однако вещество в качестве препарата не используется.
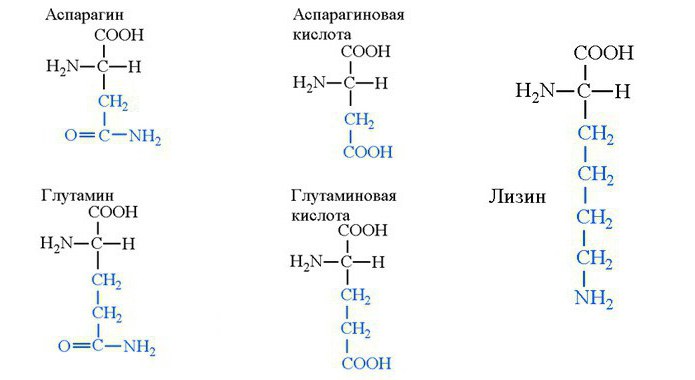
Аминокислота глутамин присутствует в крови в концентрациях, намного превышающих содержание прочих аминокислот. Она играет главную роль в биохимических механизмах азотистого обмена и выведения метаболитов, участвует в синтезе нуклеиновых кислот, ферментов, гормонов, способна укреплять иммунитет, хотя в качестве лекарственного препарата не используется. Но глутамин широко применяется среди спортсменов, так как помогает восстанавливаться после тренировок, удаляет метаболиты азота и бутирата из крови и мышц. Этот механизм ускорения восстановления спортсмена не считается искусственным и справедливо не признается допинговым. Более того, лабораторные способы уличения спортсменов в таком допинге отсутствуют. Глутамин также в значительном количестве присутствует в пище.
Аспарагиновая и глутаминовая кислота
Аспарагиновая и глутаминовая аминокислоты чрезвычайно ценные для организма человека из-за своих свойств, активирующих нейромедиаторов. Они ускоряют передачу информации между нейронами, обеспечивая поддержание работоспособности структур мозга, лежащих ниже коры. В таких структурах важна надежность и постоянство, ведь эти центры регулируют дыхание и кровообращение. Поэтому в крови присутствует огромное количество аспарагинивой и глутаминовой аминокислоты. Пространственная структурная формула аминокислот указана на рисунке ниже.
Аспарагиновая кислота участвует в синтезе мочевины, устраняя аммиак из головного мозга. Она является значимым веществом для поддержания высокой скорости размножения и обновления клеток крови. Разумеется, при лейкозе этот механизм вреден, а поэтому для достижения ремиссии используются препараты ферментов, разрушающих аспарагиновую аминокислоту.
Одну четвертую часть от числа всех аминокислот в организме составляет глутаминовая кислота. Это нейромедиатор постсинаптических рецепторов, необходимый для синаптической передачи импульса между отростками нейронов. Однако для глутаминовой кислоты характерен и экстрасинаптический путь передачи информации — объемная нейротансмиссия. Такой способ лежит в основе памяти и представляет собой нейрофизиологическую загадку, ведь пока не выяснено, какие рецепторы определяют количество глутамата вне клетки и вне синапсов. Однако предполагается, что именно количество вещества вне синапса имеет важность для объемной нейротрансмиссии.
Химическая структура
Все нестандартные и 20 стандартных аминокислот имеют общий план строения. Она включает циклическую или алифатическую углеводородную цепочку с наличием радикалов или без них, аминогруппу у альфа-углеродного атома и карбоксильную группу. Углеводородная цепочка может быть любой, чтобы вещество имело реакционную способность аминокислот, важно расположение основных радикалов.

Аминогруппа и карбоксильная группа должны быть присоединены к первому углеродному атому цепочки. Согласно принятой в биохимии номенклатуре, он называется альфа-атомом. Это важно для образования пептидной группы — важнейшей химической связи, благодаря которой существуют белок. С точки зрения биологической химии, жизнью называется способ существования белковых молекул. Главное значение аминокислот - это образование пептидной связи. Общая структурная формула аминокислот представлена в статье.
Физические свойства
Несмотря на схожую структуру углеводородной цепи, аминокислоты по физическим свойствам значительно отличаются от карбоновых кислот. При комнатной температуре они являются гидрофильными кристаллическими веществами, хорошо растворяются в воде. В органическом растворителе из-за диссоциации по карбоксильной группе и отщепления протона аминокислоты растворяются плохо, образуя смеси веществ, но не истинные растворы. Многие аминокислоты имеют сладкий вкус, тогда как карбоновые кислоты - кислые.
Указанные физические свойства обусловлены наличием двух функциональных химических групп, из-за которых вещество в воде ведет себя как растворенная соль. Под действием молекул воды от карбоксильной группы отщепляется протон, акцептором которого является аминогруппа. За счет смещения электронной плотности молекулы и отсутствия свободно двигающихся протонов рН (показатель кислотности) раствор остается достаточно стабильным при добавлении кислот или щелочей с высокими константами диссоциации. Это означает, что аминокислоты способны образовывать слабые буферные системы, поддерживая гомеостаз организма.
Важно, что модуль заряда диссоциированной молекулы аминокислоты равен нулю, так как протон, отщепленный от гидроксильной группы, принимается атомом азота. Однако на азоте в растворе формируется положительный заряд, а на карбоксильной группе - отрицательный. Способность диссоциировать напрямую зависит от кислотности, а поэтому для растворов аминокислот существует изоэлектрическая точка. Это рН (показатель кислотности), при котором наибольшее количество молекул имеют нулевой заряд. В таком состоянии они неподвижны в электрическом поле и не проводят ток.
Похожие статьи
- Для чего нужны аминокислоты и как их принимать?
- Бета-аланин: влияние, польза и вред, особенности применения
- Как принимать аминокислоты в таблетках, в порошке и жидкие? Как правильно принимать аминокислоты?
- Л-глютамин: что это такое, для чего нужен, как принимать? Как принимать Л-глютамин в порошке? Л-глютамин: отзывы
- "Глицин" для чего применяют? Инструкция, аналоги "Глицина"
- Аминокислоты в аптеке: виды, свойства и фото
- "Л-аргинин": состав, свойства, инструкция к применению, побочные эффекты
