Перхлорат натрия: формула, общие сведения, химические свойства
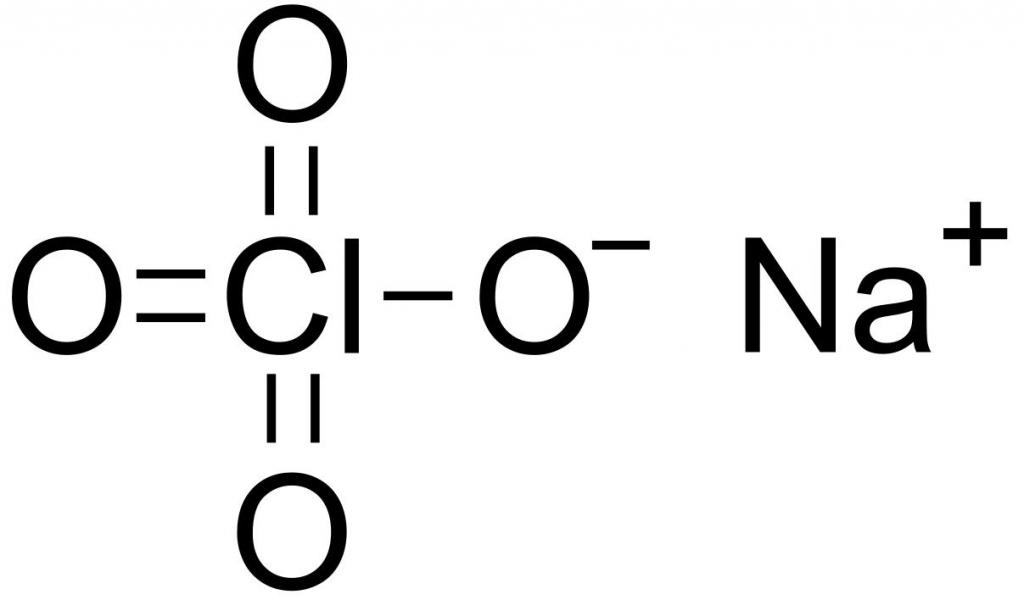
Перхлорат натрия — это кристаллическое вещество без цвета и запаха. Обладает гигроскопичностью и образует несколько кристаллогидратов. С химической точки зрения, представляет собой натриевую соль хлорной кислоты. Не горюч, но обладает токсичным действием. Химическая формула перхлората натрия – NaClO4.
Получение
Описываемое вещество может быть получено как химическим путем, так и электрохимическим. В первом случае обычно пользуются обычной реакцией обмена между хлорной кислотой и гидроксидом или карбонатом натрия. Также возможно термическое разложение хлората натрия. При 400-600 °C он образует перхлорат и хлорид натрия. Но данный способ довольно опасен, так как есть угроза взрыва при протекании реакции.
Теоретически можно осуществлять химическое окисление хлората натрия. Самым эффективным окислителем в данном случае будет оксид свинца (IV) в кислой среде. Обычно в реакционную смесь добавляют хлорную кислоту.
Чаще всего в промышленности пользуются электрохимическим способом. Он дает более чистый продукт, да и в целом более эффективен. В качестве сырья используют все тот же хлорат натрия, который при окислении на платиновом аноде дает перхлорат. Для экономичности процесса хлорат натрия получают на более дешевых электродах типа графитового. Существует также перспективный метод получения перхлората натрия в одну стадию. В качестве анода здесь используется перекись свинца.
Механизмы электрохимического получения
Полностью механизм окисления хлората в перхлорат до конца еще не изучен, существуют лишь предположения относительно него. Исследования ведутся до сих пор.
Наиболее обоснованным является вариант, основанным на предположении об отдаче электрона на аноде хлорат-иона (ClO3-), в результате которого образуется радикал ClO3. Он в свою очередь взаимодействует с водой, образуя перхлорат.
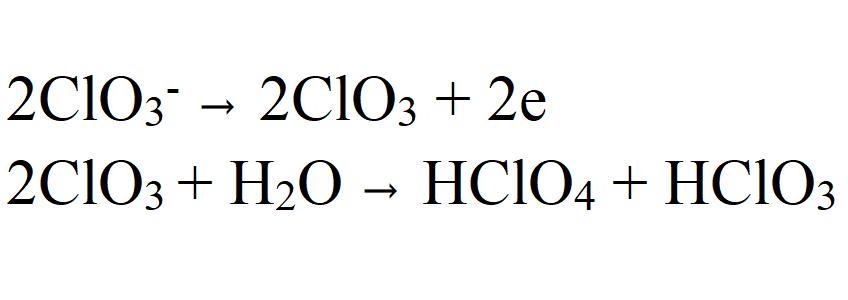
Это предположение высказывается в ряде авторитетных научных работ. Также оно подтверждается результатами исследований процессов окисления хлоратов до перхлоратов в водных растворах, меченных тяжелыми изотопами кислорода 18O. Было выяснено, что 18O входит сначала в состав хлората и только затем в ходе окислительного процесса переходит в состав перхлорат-иона. Но необходимо учитывать, что смена материала анода (например, с платинового на графитовый) может также изменить механизм реакции.
Второй вариант протекания процесса заключается в окислении ионов хлората кислородом, который образуется при отдаче электронов гидроксид-ионом.
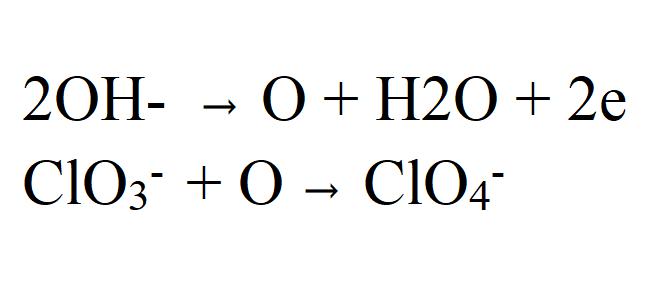
Согласно этому варианту, скорость реакции напрямую зависит от концентрации хлората в электролите, т. е. с понижением его концентрации скорость должна увеличиваться.
Существует также вариант, основанный на одновременной отдаче электронов как хлорат-ионом, так и гидроксид-ионом. Образующиеся в результате реакций радикалы обладают высокой активностью и окисляются кислородом, который выделяется от OH-.
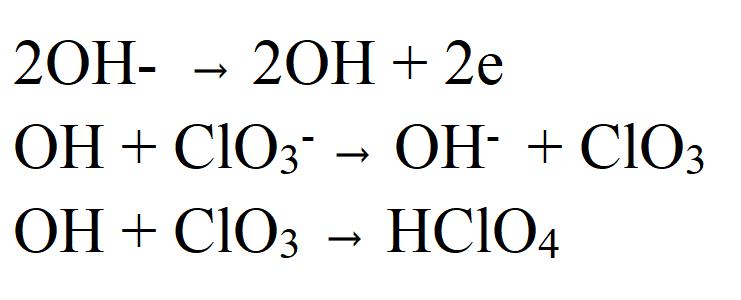
Физические свойства
Перхлорат натрия очень хорошо растворим в воде. Его растворимость гораздо сильнее, чем у других перхлоратов. По этой причине при производстве перхлоратов сначала получают перхлорат натрия, а потом при необходимости переводят его в другие соли хлорной кислоты. Также он хорошо растворим в жидком аммиаке, ацетоне, перекиси водорода, этаноле и этиленгликоле.

Как уже было сказано выше, он обладает гигроскопичностью, и при гидролизе перхлорат натрия образует кристаллогидраты (моно- и дигидраты). Также может образовывать сольваты с другими соединениями. При температуре 482 °C плавится с разложением на хлорид натрия и кислород. При использовании добавок пероксида натрия, оксида марганца (IV), оксида кобальта (II, III) температура разложения понижается до 150-200 °C.
Химические свойства
Натриевая соль хлорной кислоты — очень сильный окислитель, настолько, что окисляет многие органические вещества до углекислого газа и воды.
Обнаружить перхлорат-ион можно с помощью реакции с солями аммония. При прокаливании смеси протекает реакция:
3NaClO4 + 8NH4NO3 → 3KCl + 4N2 + 8HNO3 + 12H2O.
Еще один способ обнаружения — это реакция обмена с калием. Перхлорат калия гораздо менее растворим в воде, поэтому будет выпадать в осадок.
NaClO4 + KCl → KClO4↓ + NaCl.
С другими перхлоратами может образовывать комплексные соединения: Na2[Al(ClO4)5], Na[Zn(ClO4)3], Na[Cd2(ClO4)5].
Применение
Из-за образования кристаллогидратов, применение перхлората натрия крайне затруднено. В основном его применяют как гербицид, хотя последнее время все меньше. Почти весь перхлорат натрия переводят в другие перхлораты (например, калия или аммония) или хлорную кислоту и используют в синтезе многих других соединений за счет сильных окислительных свойств. Также его можно использовать в аналитической химии для определения и осаждения катионов калия, рубидия и цезий, причем как из водных, так и из спиртовых растворов.
При термическом разложении всех перхлоратов выделяется кислород. Благодаря этому, соли можно применять как источник кислорода в ракетных двигателях. Некоторые перхлораты могут использоваться во взрывотехнике. Перхлорат калия применяется в медицине для лечения гипертиреоза. Это заболевание обусловлено повышенной функцией щитовидной железы, а любой перхлорат обладает свойством уменьшать деятельность этой железы, что и необходимо для приведения организма в норму.
Опасность
Сам по себе перхлорат натрия негорючий, но при взаимодействии с некоторыми другими веществами может привести к пожару или взрыву. В огне он может выделять токсичные газы или пары (хлор или хлороксиды). Тушение можно производить водой.
Перхлорат натрия при комнатной температуре практически не испаряется, но при его распылении он может попасть в организм. При его вдыхании возникает кашель, раздражение слизистых оболочек. При попадании на кожу появляются покраснения. В качестве первой помощи, рекомендуется промывать места попадания обильным количеством воды с мылом, а также избавиться от загрязненной одежды. При длительном воздействии на организм, он попадает в кровь и приводит к образования метгемоглобина.
При введении животным (в частности грызунам) 0,1 г перхлората натрия у них повысилась рефлекторная возбудимость, появились судороги и столбняк. После введения 0,22 г крысы погибали через 10 часов. При введении такой же дозы голубям, у них появлялись только мягкие симптомы отравления, но через 18 часов они погибали. Это говорит о том, что отправление перхлоратом натрия развивается очень медленно.
Похожие статьи
- Бертолетова соль: химические свойства, получение и применение
- Степень и константа гидролиза
- Натрий гипохлорит: формула, применение. Обеззараживание воды гипохлоритом натрия
- Хлористый натрий. Инструкция по применению
- Гидролиз солей. Какие соли подвергаются гидролизу
- Гидроксид натрия: свойства, получение и применение
- Формула и свойства поваренной соли. Применение поваренной соли
