Основные газовые законы: описание, формулы и примеры решений

Среди всех агрегатных состояний вещества газ имеет самое простое строение - хаотичное расположение составляющих его частиц, находящихся в постоянном движении. В термодинамике для описания этого хаоса существуют несколько газовых законов, которые были установлены экспериментально. Рассмотрим основные из них подробнее в статье.
Особенности газов. Газ идеальный
Как известно, газы в отличие от жидкостей и твердых тел легко изменяют занимаемый ими объем. Достаточно газу предоставить абсолютно любое пространство, как он быстро займет его все. Как и жидкости, газы изменяют свою форму.
В общем случае в физике выделяют реальные и идеальные газы. В первых частицы взаимодействуют друг с другом, обладают некоторым объемом, а столкновения между ними не носят абсолютно упругий характер. Все названные условия не соблюдаются для идеальных газов. В действительности, все газы являются реальными, однако с очень хорошим приближением можно считать, что при атмосферном давлении и температуре, которая выше комнатной (300 К), газовые тела по своим свойствам очень близки к идеальным. Например, воздух можно полагать идеальной газовой смесью.
Как описывают газы в физике?
Поскольку изучаемое агрегатное состояние вещества не обладает определенной структурой, то остается единственный способ его описания - использование макроскопических параметров. Последние характеризуют газовые тела в общем, не вникая в их структуру.
Важными термодинамическими макроскопическими характеристиками являются следующие:
- Температура - мера энергии кинетической молекул и атомов газа. Измеряется в Кельвинах (К).
- Давление - мера количества движения, которое передает стенкам сосуда частица при столкновении с ними. Эта величина зависит от температуры и числа частиц в заданном объеме. Измеряется оно в Паскалях (Па).
- Объем - геометрическая макроскопическая характеристика, отражающая часть пространства, занимаемую газом. Измеряется в кубических метрах (м3).
Существует еще один параметр, с которым необходимо познакомиться - это количество вещества. Оно отражает число частиц, которое содержит 1 грамм атомарного водорода или 2 грамма молекулярного водорода H2. Измеряется количество вещества в молях. Один моль равен числу Авогадро (NA = 6,02*1023).
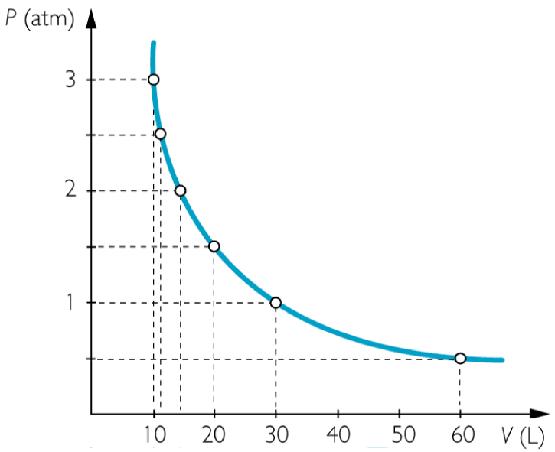
Закон Бойля-Мариотта
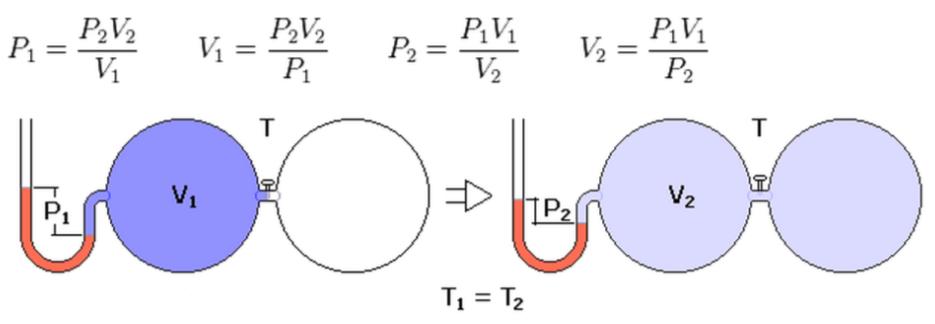
Все газовые законы были получены в результате экспериментальных исследований. Первым из них был открыт закон Роберта Бойля и Эдма Мариотта в середине XVII века. Оба ученых в процессе анализа экспериментальных данных пришли к выводу, что у газов различной природы при постоянной температуре наблюдается обратно пропорциональная зависимость между давлением и объемом. Причем константа этой зависимости при данном количестве вещества газа и данной температуре является конкретной величиной, не зависящей от химического состава. Математически закон Бойля-Мариотта записывается в виде:
P*V = const при T, n = const.
На графике зависимость P(V) представляет собой гиперболу.
Закон Шарля-Гей-Люссака
Спустя два века после открытия закона Бойля-Мариотта, была экспериментально установлена еще одна зависимость для идеальных газов. Открыл ее Шарль, а впервые опубликовал несколькими годами позже Гей-Люссак. Оба ученых независимо друг от друга установили, что если нагревать сосуд с газом, сохраняя при этом постоянным давление, то объем будет увеличиваться прямо пропорционально. Этот факт записывается математически следующим образом:
V/T = const при P, n = const.
Для этого газового закона температура зависит линейно от объема. Любой газовый процесс, идущий с неизменным давлением, называется изобарным.
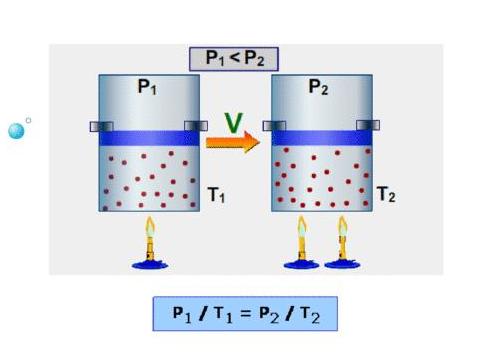
Закон Гей-Люссака
После того как Гей-Люссак опубликовал в 1802 году изложенный выше закон, в том же году он представляет аналогичный результат только для изохорного процесса, то есть процесса, который идет с постоянным объемом. Ученый установил экспериментально, что при постоянном объеме определенное количество газа независимо от его химической природы реагирует на увеличение его температуры прямо пропорциональным повышением давления, то есть:
P/T = const при V, n = const.
Как и в случае изобары, изохора на графике P(T) представляет собой прямую наклонную линию.
Принцип Авогадро
Когда рассматривают газовые законы, во многих случаях забывают упомянуть принцип Авогадро. Установлен он был итальянцем Амедео Авогадро приблизительно в 10-х годах XIX века. Этот принцип гласит, что любое увеличение количества вещества в системе приводит к прямо пропорциональному ее расширению, если давление и температура системы поддерживаются постоянными, то есть:
n/V = const при T, P = const.
Принцип Авогадро говорит о том, что одинаковые количества вещества различных газов при одном и том же давлении и одной температуре занимают одинаковые объемы. Очевидно, что график n(V) представляет собой прямую линию, наклонную к оси абсцисс.
Принцип Авогадро, по сути, является фундаментальной формулировкой закона Дальтона для газовых смесей.
Газовый закон Менделеева-Клапейрона

Мы не зря поместили обсуждение этого закона в конец статьи. Дело в том, что он объединяет все изложенные и описанные выше формулы, поэтому носит название универсального газового закона. Приведем соответствующее выражение:
P*V = n*R*T.
Видно, что это выражение объединяет все четыре макроскопических параметра (n, P, V, T), которые фигурируют в описанных ранее газовых законах. Универсальная газовая постоянная R - это величина, которая показывает значение работы, выполняемой 1 моль идеальным газом во время его расширения при нагреве на 1 К. Она равна 8,314 Дж/(моль*К).
Нетрудно догадаться, что полагая константой ту или иную величину, можно получить все предыдущие формулы для идеального газа.
Уравнение состояния было получено в первой половине XIX века французским физиком и инженером Эмилем Клапейроном, поэтому оно часто носит только его фамилию. Однако сам Клапейрон, анализируя экспериментальные данные, сформулировал это уравнение с использованием нескольких констант. Впоследствии русский химик Дмитрий Менделеев ввел понятие универсальной газовой постоянной, выразив ее через другие известные константы:
R = NA*kB.
Где kB - это постоянная Больцмана (1,38*10-23 Дж/К).

Получить газовый закон Клапейрона можно не только в результате обобщения экспериментальных данных, но также с помощью теоретических положений молекулярно-кинетической теории. В этом случае уравнение записывают в виде:
P*V = N*kB*T.
Где N - количество частиц.
Пример задачи
Водород массой 0,5 кг закачали в баллон объемом 100 литров при температуре 300 К. Необходимо определить давление в баллоне, которое будет создавать газ.
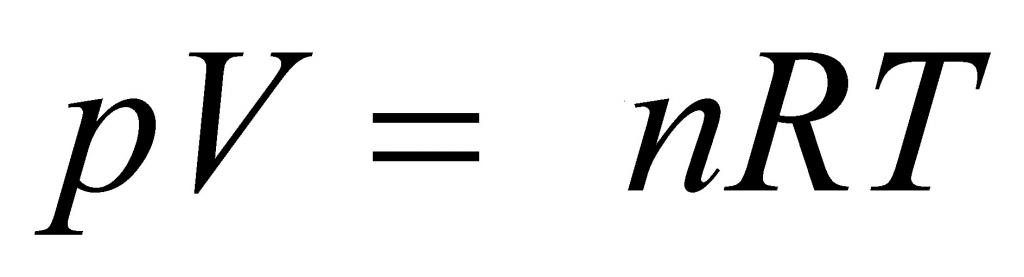
Прежде чем воспользоваться универсальным уравнением, следует привести все единицы измерения к СИ и рассчитать количество вещества n водорода. Значение объема в СИ составит:
V = 100 л = 0,1 м3.
Количество вещества n газа можно определить по следующей формуле:
n = m/MH2 = 500 г/(2 г/моль) = 250 моль.
Здесь MH2 - молярная масса молекулярного водорода.
Теперь можно воспользоваться универсальным уравнением:
P*V = n*R*T =>
P = n*R*T/V = 250*8,314*300/0,1 = 6235500 Па.
Полученное давление соответствует значению 61,5 атмосферы. При таком давлении некоторые приближения идеального газа могут не выполняться.
Похожие статьи
- Как узнать свое тотемное животное по дате рождения
- Устное народное творчество: виды, жанры произведений и примеры
- История Кёсем Султан: биография, правление и интересные факты
- Миф о Геракле: краткое содержание. 12 подвигов Геракла
- Подготовка к исповеди. Список грехов для исповеди
- Расположение органов у человека (фото). Внутренние органы человека: схема расположения
- Парные и непарные, звонкие и глухие, мягкие и твердые согласные звуки в русском языке
