Азотная кислота: свойства, получение и применение
Введение

Определение
Азотная кислота (формула HNO3) является сильной одноосновной кислотой. В неокисленном состоянии она выглядит так, как на фото 1. В обычных условиях это жидкость, но ее можно перевести в твердое агрегатное состояние. И в нем она напоминает кристаллы, имеющие моноклинную или ромбическую решетку.
Химические свойства азотной кислоты

Получение
Для получения азотной кислоты синтетический аммиак окисляют с помощью платино-родиевых катализаторов до появления смеси нитрозных газов, которые в дальнейшем поглощаются водой. Также она образуется, когда смешивают и нагревают калиевую селитру и железный купорос.

Применение
С помощью азотной кислоты производят минеральные удобрения, взрывчатые и некоторые отравляющие вещества. Ею травят печатные формы (офортные доски, магниевые клише и т.д.), а еще подкисляют тонирующие растворы для фото. Из азотной кислоты производят красители и лекарства, а также с ее помощью определяют наличие золота в золотых сплавах.
Физиологическое воздействие
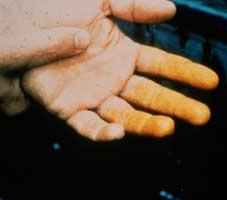
Учитывая степень влияния азотной кислоты на организм, ее относят к 3-му классу опасности (умеренно опасная). Вдыхание ее паров приводит к раздражению дыхательных путей. При попадании на кожу азотная кислота оставляет множество долго заживающих язв. Участки кожи, куда она попала, становятся характерного желтого цвета (фото). Говоря научным языком, происходит ксантопротеиновая реакция. Диоксид азота, который получается при нагревании азотной кислоты или ее разложении на свету, очень токсичен и может вызвать отек легких.
Заключение
Азотная кислота приносит пользу человеку как в разбавленном, так и в чистом состоянии. Но чаще всего она встречается в составе веществ, многие из которых вам наверняка знакомы (например, нитроглицерин).
Похожие статьи
- Глицерин: структурная формула, свойства и области применения
- Азотные удобрения и их применение. Виды азотных удобрений
- Принцип работы реактивного двигателя. Описание и устройство
- Химические свойства цинка и его соединений
- Нитраты - это что такое? Реакции нитратов. Растворы нитратов
- Нитрат аммония: свойства, получение, применение
- Травление металлов. Процесс травления, способы и оборудование
