Redox. Окислительно-восстановительные реакции: описание, примеры
Окислительно-восстановительные реакции – редокс – представляют собой взаимодействие встречно-параллельного характера. В процессе этих явлений изменяются некоторые характеристики компонентов. Данные взаимодействия реализуются методом перераспределения электронов. Этот процесс происходит между атомами-окислителями и восстановителями.
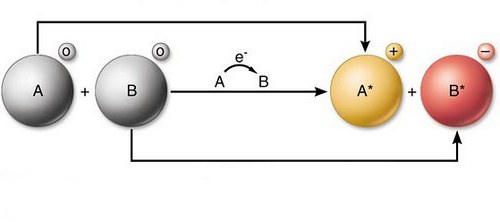
Свойства компонентов
Органическая химия предполагает использование широкого ряда окислителей и восстановителей. Это позволяет выбирать определенный реагент, который обладает селективностью. То есть, компонент способен воздействовать избирательно на те или другие функциональные категории. Кроме того, благодаря такой широте выбора, появляется возможность получить продукты в заданной степени окисления. Так, к примеру, борогид Na способен не вступать во взаимодействие со сложными эфирами и амидами. При этом он восстанавливает альдегиды либо кетоны до спиртов. Среди второй группы компонентов также существуют высокоселективные соединения. В качестве примера можно привести комплекс CrO3 и пиридин. Эта структура окисляет в кетоны спирты с высоким выходом. При этом соединение не затрагивает С-С связи. Высокой селективностью отличается и SeO2. Соединение окисляет альдегиды и кетоны до альфа-дикарбонильных соединений.
Общая информация
Окислительно-восстановительные реакции предполагают разное изменение свойств входящих компонентов. Оно зависит от характера взаимодействия. Так, при восстановлении снижается, а при окислении – повышается степень окисления элементов. Первоначально термин трактовался достаточно просто для понимания. Так, окислением считалось прибавление кислорода, восстановлением – отнятие его, соответственно. После введения в науку электронных представлений, определение было несколько расширено. С того момента понятие распространяется и на взаимодействия, в которых кислород не участвует.
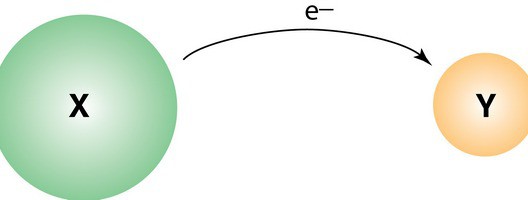
Характеристика процессов
Окислительно-восстановительные реакции формально представляют собой перемещение электронов. Компоненты от атома одного реагента переходят к атому другого. Так, окисление, проще говоря, представляет собой отдачу электронов. В ряде случаев в процессе молекула в исходном веществе может стать нестабильной. В результате она может распасться на более мелкие, но при этом и с высокой степенью стабильности, компоненты. Атомы окисляемых веществ принято называть донорами электронов, структурные элементы окислителя – акцептами, соответственно. Прямо противоположно протекает процесс присоединения электронов. Называется он восстановлением. Во взаимодействии этого рода могут принимать разные элементы. Например, углерод, водород и прочие. Восстановлению могут подвергаться разные соединения. Например, органические кислоты в спирты и альдегиды.
Типы окислительно-восстановительных реакций
В соответствии с формальными признаками рассматриваемые взаимодействия разделяют на внутри- и межмолекулярные. К последним, например, можно отнести 2SO2 + O2 → SO3. Также окислительно-восстановительные реакции классифицируют на диспропорционные и репропорционные. В первом случае один и тот же элемент имеет разные свойства. Так, компонент может одновременно являться и восстановителем и окислителем:
Cl2 + H2O → HClO + HCl.
Другой вид – репропорционирование или конпропорционирование – представляет собой несколько иные взаимодействия. В таких реакциях из двух разных степеней окисления у одного элемента выходит одна:
NH4NO3 → N2O + 2H2O
Каталитические процессы
Внутри данных взаимодействий обеспечивается высокая способность к селективности. Так, к примеру, в соответствии с катализатором и условиями ацетиленовые углеводороды можно избирательно подвергать гидрированию до насыщенных или этиленовых. А восстановление СО2 до СО электрохимического вида в водной среде при наличии 1,4,8,11-тетраазациклотетрадекана никелевого комплекса дает возможность провести процесс при сниженных потенциалах и подавлять одновременно электролиз воды при образовании Н2. Данное взаимодействие обладает ключевым значением при превращении через СО СО2 в разные органические вещества.
Значение
Окислительно-восстановительные реакции каталитического характера выполняют важные задачи в промышленности. Они достаточно широко распространены в природе и используются в технике. Также в основе жизнедеятельности лежат окислительно-восстановительные реакции, протекающие при транспорте электронов, дыхательной деятельности, фотосинтезе. Эти взаимодействия обеспечивают основную долю энергопотребления людей за счет сжигания различного органического топлива.
Течение взаимодействий
Часто окислительно-восстановительные реакции сопровождаются повышенным выделением энергии. Это позволяет их использовать при получении, например, электроэнергии. Наиболее бурно взаимодействия протекают при отсутствии растворителя. При его наличии такие реакции могут не произойти. Это может быть связано с тем, что произойдет взаимодействие одного либо обоих компонентов с растворителем. Можно привести следующий пример. В водном растворе реакция 2Na + F2 → 2NaF невозможна. Это связанно именно с тем, что фтор и натрий отличаются бурным взаимодействием с Н2О. На свойства ионов при окислительно-восстановительных реакциях большое влияние оказывает комплексообразование. Так, к примеру, происходит с [C02+(CN)6]4-. Этот комплекс, считается сильным восстановителем, в отличие от СО2+ гидратированного иона.
Органическая химия. Окислительно-восстановительные реакции
В данной дисциплинарной сфере применение обобщенных концепций и понятий о течении и характере процесса считается малопродуктивным. Это особенно актуально при наличии незначительной полярности межатомной связи. В органической химии принято рассматривать окисление как процесс повышения кратности кислотосодержащих или повышение количества водородосодержащих связей. В ряде случаев используется подход, предполагающий приписывание в молекуле атомам С разные степени окисления.

Это, в свою очередь, зависит от количества связей, сформированных с компонентом, имеющим большую электроотрицательность, чем водород. В таком случае расположение функциональных производных будет осуществляться в порядке возрастания степеней окисления. Так, к примеру, насыщенные углеводороды следует относить к нулевой группе (ст. окисл. – 4), ROH, RNH2, RCl – к первой (-2), R2CCl2 и R2CO – ко 2-й (0), RCCl3 и RCONH2 – к 3-й (+2), СО2 и CCl4 – к 4-й (+4). В данном случае понятно, что окисление представляет собой процесс, при котором соединения переходят на более высокий уровень, а восстановление – процедура обратная. При исследовании взаимодействий особое внимание следует уделять механизмам, благодаря которым протекают процессы. Надо отметить, что данные факторы весьма многообразны. Так, реакции могут проходить по гомолитическому или гетеролитическому механизму. Однако во многих случаях в качестве начальной стадии взаимодействия выступает процедура одноэлектронного переноса. Процесс окисления, как правило, характеризуется течением по положениям с наивысшей плотностью, а восстановления – по позициям, где электронная плотность составляет минимум.
Похожие статьи
- Окислительно-восстановительные реакции (ОВР): примеры
- Что такое ОВР (химия)? ОВР: примеры и решение
- Окислительно-восстановительный потенциал: расчет и измерение
- Химические свойства цинка и его соединений
- Как определить степень окисления: таблица Менделеева и алгоритм действий
- Сернистый газ — физические свойства, получение и применение
- Основные законы химии. Основные понятия и законы химии
