Основные законы химии. Основные понятия и законы химии
Будет не лишним сначала дать определение термину «химия» - это важнейшая наука, которая изучает строение веществ, их превращения. Она включает следующие основные понятия и законы (химии):
1. Химические свойства любого вещества устанавливаются, исходя из состояния электронных оболочек (внешних) молекул, атомов, его образующих. Ядра и внутренние электроны в ходе химических процессов практически не изменяются.
2. Объект химии – химические элементы, их комбинации (атомы, простые, сложные: ионы, карбены, свободные радикалы, молекулы, ион-радикалы, а также материалы, химические соединения, их объединения: кластеры, клатраты, ассоциаты, сольваты и др.). Их существует огромное количество , и оно постоянно растет ввиду того, что данная наука сама формирует свой объект (уже известно приблизительно 10 млн. химических соединений).
3. Вещество – это разновидность материи, обладающей определенной массой покоя и состоящей из таких элементарных частиц, как электроны, нейтроны, протоны, мезоны и т. п. Данная наука изучает такие вещества, которые преобразованы в атомы, ионы, молекулы и радикалы. Они бывают: сложные, простые (химические соединения).
4. Наименьшая составляющая химического элемента, которую невозможно разделить химическим путем и которая сохраняет все первоначальные свойства, определенные электрической оболочкой и зарядом ядра, называется атом. Часть вещества (составная), содержащая идентичные атомы, именуется химическим элементом, каждому их которых соответствует комплекс определенных атомов.
5. Молекула – это микрочастица, имеющая 2 или более атома, и которая способна к автономному существованию. Она обладает неизменным количественным, качественным составом ядер атомов, а также постоянным количеством электронов; оснащена уникальными свойствами.
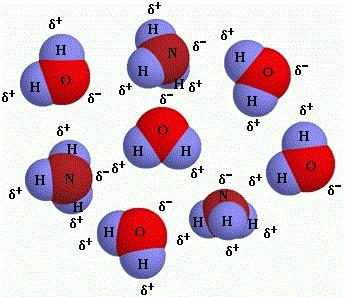
6. Простые вещества образуются посредством атомов только 1-го химического элемента, ввиду чего выступают особой формой его пребывания в свободном состоянии (O₂, H₂, He, O₃, S₈), а сложные вещества сформированы разными химическими элементами и они могут иметь неизменный состав (дальтониды либо стехиометрические соединения) либо переменный (бертоллиды либо нестехиометрические соединения).
7. Ионы – это одно- либо многоатомные частицы, обладающие электрическим зарядом. Положительно заряженные ионы – это катионы, а отрицательно – анионы. В форме газа они пребывают в своем свободном состоянии.
8. Валентность – это способность атома замещать либо присоединять другие атомы (атомные группы) и образовывать химические связи. Мера валентности – количество атомов водорода (кислорода), которые присоединены к химическому элементу. Водород является одновалентным, а кислород – двухвалентным.
9. Химические реакции - это трансформация одних веществ (первоначальных соединений) в вещества иного рода (продукты реакции), которая не изменяет ядра атомов.
10. Реагенты – исходные вещества либо одно наиболее активное исходное соединение, которое определяет направление реакции.
Происхождение рассматриваемого термина
Существует 2 точки зрения касательно его происхождения:
- От древнего названия Египта - "Хем", что дословно переводится как «черный, «темный». Предположительно из-за цвета почвы долины р. Нил.
- От древнегреческого термина «chemeia» - вид искусства выплавки металла.
Современное название происходит от латинского слова «chimia». Оно является интернациональным (к примеру, по-немецки chemie, по-французски chimie, по-английски chemistry). Известно, что родоначальник термина «химия» - греческий алхимик Зосима (V в.).
Органическая химия: определение, органические соединения
Это наука, исследующая углеродные соединения, которые произведены живыми организмами. На сегодняшний день известно больше 2-х млн. органических соединений, подразделяющихся на такие группы, как алкены, спирты, алканы и т. п. Большинство среди них включены в состав нефти и занимают главенствующие позиции в производствах: красителей, лекарств, пластмасс, косметики.
Состав органических соединений: атомы углерода и иных элементов (кислорода, водорода), которые соединены крепкими ковалентными связями. Те соединения, которые сформированны из атомов углерода с водородом, именуются углеводородами.
Главный компонент природного газа – простой углеводород (Метан – CH₄). Органическая химия исследует именно органические соединения, дифференцированные по семействам, и которые называются гомологическими рядами.
Вышеупомянутые группы (алкены, алканы) относятся к различным гомологическим рядам, каждый их которых включает тысячи соединений. Их местоположение в данном ряду устанавливается количеством атомов углерода внутри молекул (к примеру, молекулы 1-х трех соединений ряда алканов: метан – 1 атом углерода, этан – 2, пропан - 3).
Наименования соединений, которые содержат 1 атом углерода, начинаются с приставки «мет», 2 атома – «эт», 3 атома – «проп». Такие соединения, относящиеся к 1-му гомологическому ряду, обладают схожими химическими свойствами, но различными – физическими. А те соединения, которые имеют мало атомов углерода, являются газами, достаточно большое количество атомов – жидкостями, чрезмерно перенасыщены атомами твердые вещества.
Количество органических соединений достаточно велико ввиду способности атомов к образованию длинных цепочек либо колец. Данные структурные единицы слепливаются благодаря ковалентным связям (их электроны внешних оболочек «общедоступны»). Углерод образует простые (каждая атомная пара делит между собой 1 пару электронов), 2-ые либо даже 3-ые ковалентные связи (участвуют две и, соответственно, три пары электронов).
При реакции достаточно насыщенного соединения (органического) с иным соединением существующие связи разрываются, а некоторые атомы замещаются другими.
Основные стехиометрические законы химии
Они входят в такой раздел химии, как стехиометрия. Известно, что там содержатся следующие основные законы химии:
- Гей-Люссака;
- Авогадро;
- эквивалентов и сохранения масс;
- кратных отношений;
- постоянства состава.
Сущность закона сохранения массы и энергии
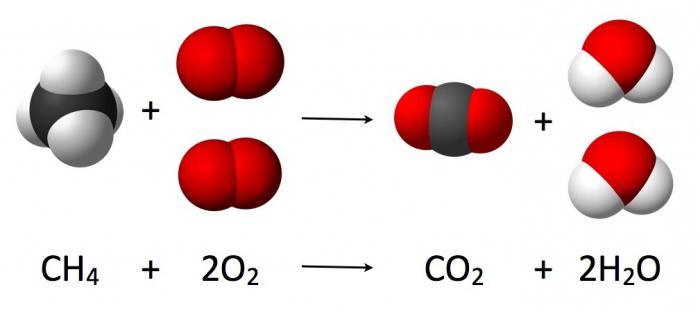
Основа формирования химических уравнений – метод материального баланса, база которого - закон сохранения массы (химия). Согласно ему, масса реагентов идентична массе конечных продуктов реакции.
Он впервые был открыт М. В. Ломоносовым в 1748 году. Затем к таким же результатам пришел и французский химик А. Лавуазье (1789 г.).
В процессе химической реакции количество взаимодействующих атомов неизменно (наблюдается лишь их перегруппировка, сопровождающаяся разрушением первоначальных веществ). Протекающее взаимодействие кислорода с водородом, которое приводит к образованию воды, можно записать посредством уравнения соответствующей химической реакции (как на рисунке ниже).
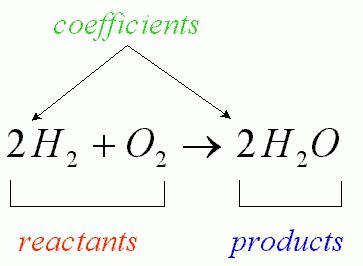
Перед формулами данных химических соединений стоят коэффициенты, которые носят название «стехиометрические». Современная формула расшифровывается следующим образом: сумма масс и энергий в рамках изолированной системы постоянна.
Она имеет вид: E = m · c², где
с – скорость света (3 · 10⁸ м/с);
В начале XX века Альбер Эйнштейн сумел доказать справедливость данного уравнения относительно любой формы материи.
Суть закона постоянства состава
Он был сформулирован французскими химиками Ж. Прустом и К. Л. Бертолле в 1808 г. В нем говорится о том, что любое индивидуальное вещество, полученное любым известным способом, всегда имеет неизменный количественный и качественный состав.
Закон постоянства вещества (химия) дал возможность выразить состав веществ посредством химических знаков, соответствующих индексов (например, H₂O, C₂H₅OH, CH₄). В начале XX века (1912 – 1913 гг.) выдающийся русский профессор Н. С. Курнаков выявил существование соединений переменного состава, которые назвал бертоллидами.
Если вспоминать очередной урок химии, закон постоянства состава считается справедливым для веществ, которые обладают молекулярным строением. Как уже было упомянуто ранее, кроме веществ с постоянным составом, существуют и вещества с переменным: чередование монолитных структурных единиц (ионов, атомов) протекает с нарушением установленной периодичности.
Ввиду присутствия соединений, имеющих переменный состав, закон постоянства состава (химия) содержит уточнения по поводу того, что существует прямая зависимость структуры состава соединений и способов их получения: если имеет место молекулярное строение, то состав не изменяется в зависимости от любого способа получения, но в ситуации, когда структура немолекулярная (ионная, атомная и металлическая решетка) – состав зависит от конкретных условий получения.
Формулировка закона эквивалентов
Он открыт немецким химиком Н. Рихтером и заключается в следующем: массы веществ, вступающих во взаимодействие (химическое), равны либо кратны массам их химических эквивалентов (химия 11 класс).
Эквивалент – это условная либо реальная частица веществ, способная замещать, высвобождать, присоединять и т. д., которая равна 1-му иону водорода ионно-обменных либо кислотно-основных реакций; 1-му электрону окислительно-восстановительных реакций.
По-другому, можно сказать, что моль эквивалентов (определенное количество вещества, содержащего столько же структурных элементов, сколько атомов углерода находится в 12 г. изотопа ¹²C) 1-го вещества вступает в реакцию с точно таким же молем эквивалентов, но уже другого вещества.
Математически данный закон имеет вид:
mₐ : Mₔ(A) = mᵦ : Mₔ(B), где
mₐ – масса некоторого вещества A,
mᵦ – масса какого-либо вещества B,
Mₔ(A) – масса (молярная) эквивалента соответствующего вещества A,
Mₔ(B) - масса (молярная) эквивалента соответствующего вещества B.
Бывает, что одно вступающее в реакцию вещество первоначально пребывает в твердом состоянии, а другое – в газообразном. Тогда рассматриваемый закон выражается следующей формулой:
mₐ : Mₔ(A) = Vb : Vₔ(B).
Сущность закона кратных отношений
Он сформулирован английским химиком Д. Дальтоном в 1803 году. Его суть в том, что в ситуации, когда 2 химических элемента создают несколько соединений (молекулярных), массовые доли любого из них соотносятся как целые числа (химия 11 класс).
В процессе взаимодействия кислорода и азота получаются 5 оксидов. В возникающих молекулах на 1 г азота приходится следующее количество кислорода в граммах: 0,57, 1,14, 1,71, 2,28, 2,85. Они соотносятся в пропорциях: 2:1, 1:1, 2:3, 1:2, 2:5 (составы: N₂O, NO, N₂O₃, NO₂, N₂O₅).
Законы Авогадро и объемных отношений
Суть последнего: в идентичных условиях объемы газовых реагентов соотносятся касаемо друг друга и объемов возникающих газовых продуктов как целые числа (Ж. Гей-Люссак).
В случае взаимодействия газовых веществ их объемы соотносятся как коэффициенты (стехиометрические) уравнения реакций: 2H₂ + O₂ = 2H₂O (г).
Что касается закона Авогадро, то его формулировка следующая: идентичные объемы газа в рамках одинаковых условий содержат одно и то же количество молей.
Математически это можно представить так:
n(x) = m : M (x), где
n(x) – искомое количество молей вещества,
m – масса соответствующего вещества,
M (x) – молярная масса вступающего в реакцию вещества.
Следствия этого закона:
- Газообразное вещество в 1 моль заменяет объем в 22,4 л (в нормальных условиях).
- Газообразное вещество в 1 моль содержит идентичное количество молекул, которое равно 6,023 1023 – число Авогадро.
- При известных массах газообразных веществ либо их молярных массах можно определить относительную плотность: mₐ : mᵦ = pₐ : pᵦ, где
pₐ, pᵦ - плотность веществ A и B, г/см³.
Итак, выше были перечислены основные законы химии (стехиометрические). Далее будут рассмотрены газовые и термодинамики.
Газовые законы химии
Всего четыре закона:
1. Бойля – Мариотта: если температура – величина постоянная (T = const) в рамках изотермического процесса, то производимое массой газа давление обратно пропорционально его объему: pV = const.
2. Гей-Люссака: если давление газа неизменно (р = const) в рамках изобарического процесса, то его объем находится в прямой пропорциональной зависимости от абсолютной температуры: V : T = const.
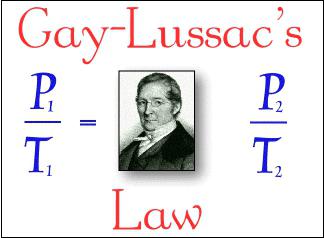
3. Шарля: если объем газа – величина постоянная в рамках изохорического процесса, то его давление находится в прямой пропорциональной зависимости от абсолютной температуры: P : T = const.
4. Объединенный газовый: pV : T = const.
Это основные газовые законы химии.
Законы химической термодинамики
Их три:
1. Закон сохранения энергии (химия): если в ходе любого процесса энергия 1-го вида исчезнет, то на замену ей "приходит" иная форма энергии и в другом количестве, которое строго эквивалентно 1-му. Поэтому, можно сказать, что в пределах любой изолированной системы совокупный энергетический запас остается неизменным.
2. В границах изолированной системы процессы, которые протекают самопроизвольно, увеличивают энтропию (превращение) системы.
3. Если температура стремится к нулю, то энтропия системы остается неизменной (не зависит от ее параметров).
Это основные законы термодинамики (химия).
Сущность закона действующих масс
Это основной закон физической химии. Закон действия масс (в химии): скорость, с которой протекает химическая реакция, находится в пропорциональной зависимости от произведения концентраций реагентов.
В случае гомогенной реакции с 1-ой стадией (A + B - продукты реакции) этот закон можно представить в виде уравнения:
v = k · cₐ · cᵦ, где
v – скорость реакции,
cₐ, cᵦ - концентрации реагентов соответственно A и B, моль / л,
k – константа скорости реакции.
Закон действия масс (в химии) позволяет выявить физический смысл данной константы: она равна скорости протекания реакции при значениях концентраций реагентов в 1 моль/л либо значении их произведения, равного единице. Константа находится в зависимости от температуры, природы реагентов, но не от их концентраций.
Периодический закон: формулировка, роль
Признано, что данный закон – это важнейшее достижение в химии, можно сказать, основа современной химии. После его открытия она перестала быть исключительно описательной наукой, стало возможным так называемое научное предвидение.
Периодический закон (химия) был открыт известным русским ученым Дмитрием Ивановичем Менделеевым в 1869 году. Официальная формулировка: «Свойства простых тел, также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов».
Это основные законы химии (физической).
Химия в качестве системы знаний касаемо веществ, их превращений
Знания черпаются из достоверных обширных сведений о соединениях и элементах (химических), их реакциях, поведении в рамках природной и искусственно созданной среды. Существующие критерии надежности изучаемых фактов, а также способы их упорядочивания непрерывно эволюционируют. Крупные обобщения переходят в научные законы, формулировка которых дает возможность для открытия новых этапов химии (например, основные законы химии: закон Дальтона, периодический закон Менделеева и др.). Теоретические аспекты, в которых применяются специфические понятия, позволяют объяснить и спрогнозировать факты более узкой предметной области. Следовательно, можно сказать, что знание, подкрепленное опытом, становится фактом лишь после его теоретического истолкования.
Таким образом, первая химическая теория – это теория «флогистона» (признана неверной), она способствовала становлению современной химии, ввиду того что она соединяла разрозненные факты в единую систему, позволяла формулировать ряд новых вопросов. А вот структурная теория (Ф. Кекуле, А. М. Бутлеров) помогла упорядочить и объяснить обширный материал химии органической и обусловить ускоренное развитие химического синтеза, а также изучения структуры органических соединений.
Рассматриваемая наука в качестве знания – система весьма динамичная. Эволюционный характер процесса накопления знаний периодически прерывается революциями – коренной перестройкой системы теорий, методов и фактов с появлением новой совокупности понятий либо даже принципиально нового стиля мировоззрения и мышления. Итак, революцию вызвали труды Антуана Лорана Лавуазье (внедрение количественных методов эксперимента, материалистическая теория окисления, разработка химической номенклатуры), периодический закон Менделеева, разработка новых аналитических методов (хроматография, микроанализ), возникновение новых сфер, формирующих новое видение существующего предмета химии и воздействующих на все ее области (к примеру, физическая химия, основанная на базе химической кинетики и термодинамики).
Также стоит отметить, что химическое знание оснащено развитой структурой, химический каркас которой – главные химические дисциплины, сформировавшиеся в XIX веке (органическая, аналитическая, неорганическая и физическая химия). Впоследствии в процессе ее эволюции появилось множество новых дисциплин (био- и кристаллохимия, др.) и инженерная отрасль –химтехнология.
Итак, в статье были рассмотрены основные понятия и законы химии.
Похожие статьи
- Что такое моль в химии
- Алхимия - это донаучное направление в развитии химии. Алхимия: описание, история, философия и интересные факты
- Что такое число Авогадро?
- История химии: описание, возникновение и развитие
- Законы термодинамики и их описание
- Первое начало термодинамики -объяснение этого закона и практические примеры.
- Периодический закон химических элементов Дмитрия Ивановича Менделеева

