Гомогенные реакции: описание и примеры
Для правильного проведения химических реакций важно знать, в каких условиях они протекают. Гомогенная среда реагентов позволяет определять скорость их взаимодействия. Существуют особые факторы, которые могут замедлять или ускорять гомогенные реакции.
Классификация
Химические взаимодействия можно разделить на разные группы, благодаря присутствию большого числа критериев.
Существуют следующие признаки:
- Наличие раздела реакционной фазы. Реакции могут быть гомогенными или гетерогенными.
- Изменение окислительной степени реагирующих веществ.
- Выделение или поглощение тепла.
- Тип изменений реагирующих веществ, связанных с соединением, разложением, замещением или обменом.
Гомогенная среда
Это однородная система, в которой химические и физические характеристики компонентов в любой ее точке постоянны, а если они изменяются, то в непрерывном темпе, без проявления резких скачков. Все ее части не имеют поверхностного разделения. Так протекают гомогенные химические реакции.
Наличие нескольких реагентов в однородной фазе нельзя визуально определить или отделить их механическим способом. Такая особенность возможна благодаря равномерному распределению составных частиц одного компонента в другом.
К примерам однородных фаз следует отнести газовые смеси, замерзшую воду, растворы в жидкой или твердой форме.
Определение гомогенных взаимодействий
Их еще называют гомофазными реакциями. Это процессы, протекающие в области одной однородной среды, а реагирующие компоненты и получаемые продукты находятся в неизменном состоянии.
Гомогенные реакции имеют величины, которые остаются в одинаковых показателях, а если они меняются, то с непрерывной скоростью.
Когда процессы проходят в области разделения двух фаз, то их называют гетерогенными.
Если реакции многостадийные, то они могут быть смешанного типа. В них начальные этапы протекают в гомогенной среде, а конечные процессы в гетерогенной фазе. Такие взаимодействия чаще всего происходят в природе.
Гомогенные реакции, примеры уравнений
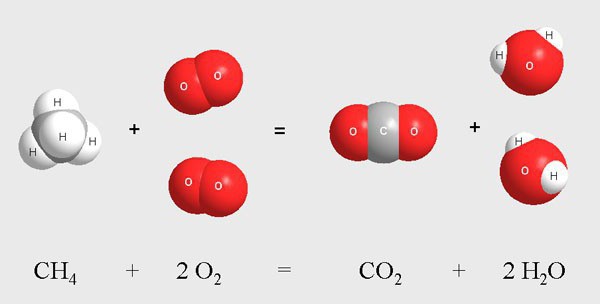
К ним относят процесс хлорирования молекул метана в газовой среде. Данная реакция протекает при высокой температуре или при воздействии ультрафиолета. В результате смешивания метана и хлора происходит поэтапное взаимодействие экзотермического типа.
Промежуточными продуктами являются газообразные вещества, к которым относят молекулы хлорметана, дихлорметана, трихлорметана, хлороводорода. Во время реакции происходит постепенное замещение атомов водорода в метане на атомы хлора. Конечным веществом служит четыреххлористый углерод.

H2CH2↑ + ClCl↑ → H2CHCl↑ + HCl↑
H2CHCl↑ + ClCl↑ → H2CCl2↑ + HCl↑
H2CCl2↑ + ClCl↑ → HCCl3↑ + HCl↑
HCCl3↑ + ClCl↑ → CCl4↑ + HCl↑
Существуют и одноэтапные гомогенные реакции. Примеры таких взаимодействий указаны ниже.
К гомофазным процессам можно отнести:
- расщепление оксида пятивалентного азота в газовой среде под действием высокой температуры: N2O5↑ + N2O5↑ → NO2 + NO2 + NO2 + NO2 + O2;
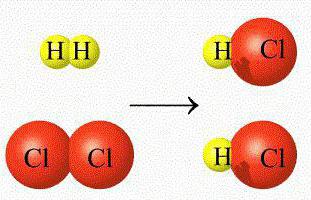
- нейтрализацию раствором гидроксида натрия раствора соляной кислоты, с образованием раствора хлорида натрия и воды: HCl + NaOH → NaCl + H2O;
- этановое горение с выделением оксида четырехвалентного углерода и водяного пара: С2Н 6↑ + С2Н 6↑ + 7О2↑ → 4СО2↑ + 6Н2О↑;
- превращение молекулярного кислорода во время грозы в озон: 3О2↑ → 2О3↑.
Гомогенные реакции достаточно часто протекают в жидкой среде. К ним причисляют процессы галоидирования, расщепления всевозможных сложных соединений на более простые или на радикалы, замещение одних атомов другими по нуклеофильному или электрофильному типу, отщепление частей молекулы или их перегруппировка, удлинение цепочки за счет полимеризации, окислительное взаимодействие. В результате образуются жидкие продукты.
Скорость реакций гомогенных
Протекание того или иного процесса может занимать разные временные промежутки. Важной характеристикой такого взаимодействия является скорость гомогенной реакции. Представляет она числовую величину, которая определяет изменение концентрации любого реагента за временной промежуток.
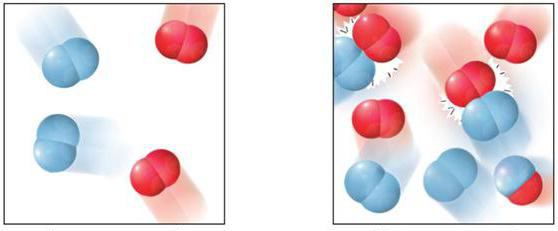
Ее можно охарактеризовать по-другому: как значение, устанавливающее перемену количества взаимодействующего компонента в заданном объеме за определенное время. Главным условием является отсутствие изменения массы в системе.
При расчете скорости реакции в гомогенной среде (обозначают как Vi) используют убыль или прирост молярного количества реагирующего вещества (Ci) за определенное время (t). Существует специальная формула расчета:
Vi = ± Ci / t.
Для химического процесса HCl + NaOH → NaCl + H2O быстроту протекания можно определить по уменьшению концентрации каждого реагента (соляной кислоты или натрия гидроксида) или по увеличению количества продуктов превращения (натрия хлорида или воды) за временной промежуток при постоянных температурных условиях.
Для определения скорости гомогенных реакций концентрацию берут в молях на литр, а время измеряют в секундах. Расчет производится следующим образом:
Vi = ± Ci / t = − [HCl] / t = − [NaOH] / t = [NaCl] / t = [H2O] / t.
Факторы, влияющие на скорость
Гомогенной является реакция, у которой быстрота протекания данного процесса прямо пропорциональна заданному веществу в единице объема. Чем больше молекул задействовано, тем быстрее осуществляется взаимодействие.

Основными факторами, влияющими на скорость процессов в однородной среде, являются концентрация реагентов и продуктов реакции, их химическая природа, температурные условия, давление в реакционном объеме, а также наличие ускорителей, катализирующих изменения.
Зависимость быстроты протекания реакций от нагревания была установлена ученым Вант-Гоффом. Согласно его утверждению, каждое температурное повышение на 10° увеличивает в гомогенных реакциях скорость в 2 или 4 раза. В более теплой среде молекулы начинают активнее двигаться, сталкиваться друг с другом, что приводит к их взаимодействию.
Гомогенные реакции со временем протекают с разной интенсивностью, поэтому их скорости могут быть истинными (в определенный момент) и средними, что следует учитывать при расчетах.
Похожие статьи
- Типы химических реакций. Классификация химических реакций
- ТВЭЛ - это тепловыделяющий элемент. Ядерный реактор
- Химические реакции: изменчивый мир
- Каталитические реакции: определение, описание, примеры
- Экзотермическая реакция - это процесс, сопровождаемый выделением энергии
- Реакция нейтрализации: определение, примеры, применение
- Химические и физические способы разделения смесей
