Типы химических реакций. Классификация химических реакций
Понятие о том, какие бывают типы химических реакций, неразрывно связано с базовым знанием предмета, который в обязательном порядке преподается в школе. В отличие от физических метаморфоз, в химии происходит превращение вещества из одного или нескольких в другое или несколько других. На этом и основаны практически все типы химических реакций.
Факторы химической реакции
На сегодняшний день определено достаточно большое количество реакций, которые так или иначе относятся к области химии и физики. Однако классификация химических реакций такова, что о них можно судить по некоторым основным признакам. Чаще всего это признаки визуального характера.

К примеру, самым простым способом определить, прошла химическая реакция или нет, можно назвать изменение цвета вещества или раствора, выпадение осадка, выделение газа и т.д. Все это нетрудно заметить, как говорится, даже на глаз. В некоторых случаях такой метод не срабатывает. В частности, это касается жидких реагентов типа кислот и щелочей при растворении в воде. Хотя данный процесс и относится сугубо к физическим процессам, тем не менее гидратация или гидролиз рассматриваются именно с точки зрения такой науки, как химия. Химические реакции определяются дополнительными средствами. К примеру, если заняться определением pH раствора, здесь визуально ничего видно не будет. Для индикации используются растворы или лакмусовая бумага, которая окрашивается в определенный цвет в зависимости от кислотности среды.

Однако только визуальными эффектами определение не ограничивается. Тому подтверждением могут служить и другие не менее заметные факторы, которые проявляются при течении или окончании процесса. И их существует достаточно много.
Не менее интересным признаком является повышение температуры или возгорание соединения. Достаточно вспомнить школьные опыты, когда кусочек калия бросают в воду, после чего происходит выделение водорода. Если взять достаточно большой кусок этого металла и нужное количество воды, можно добиться даже того, что просто произойдет взрыв неимоверной силы. Заметьте, такие случаи в истории, к сожалению, не единичны.

Основные типы химических реакций
Что касается того, какие типы химических реакций можно выделить на современном этапе развития науки химии, то здесь можно для начала упомянуть, что процессы изначально и условно можно разделить на гомогенные и гетерогенные. Гомогенные процессы происходят в одной фазе (скажем, жидкость), а гетерогенные реакции в качестве основных реагентов используют несколько состояний вещества (жидкость, твердое вещество, газ и т.д.).
Но такое разделение на типы химических процессов является далеко не единственным, поскольку здесь нужно брать в расчет именно преобразование веществ, участвующих в реакции, из одного в другое.
Те же алхимики пытались когда-то получить золото из свинца. На самом деле этот процесс к химии можно отнести весьма опосредованно.

По сути превращение одного элемента в другой относится, скорее, к области ядерной физики. Сегодня можно произвести такой процесс, однако золото, получаемое таким способом, становится очень сильно радиоактивным, неимоверно дорогим, и к использованию просто непригодно.
Однако в основном понимании разделения на классы химических реакций стоит выделить наиболее распространенные типы. За основу принято четыре основных класса: реакции соединения, разложения, замещения и ионного обмена. Есть еще и пятый тип, который не вписывается по своей сути ни в один из выше перечисленных классов. Это окислительно-восстановительные реакции, в которых, как правило, основным реагентом выступает перманганат калия (KMnO4), считающийся наравне с кислотами одним из самых сильных окислителей, известных человечеству.

Реакции соединения
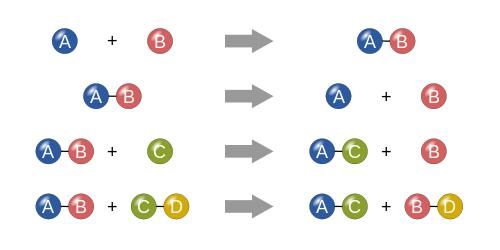
Если говорить о том, что собой представляют условия химических реакций этого типа, условно сам процесс можно представить в виде некоего математического выражения. Допустим, у нас есть два вещества. Условно обозначим их как «A» и «B». В данном случае реакция будет иметь вид следующей формулы:
A + B = AB
Как уже понятно, происходит просто слияние двух компонентов (неважно, простые это или сложные вещества, представляющие собой соединения).
Самым простым примером может быть образование оксидов. Например:
S + O2 = SO2
Реакции разложения
Собственно, классификация химических реакций невозможна без понимания процессов разложения. Исходя из вышеприведенного примера, сам процесс можно представить в виде формулы:
X = AB – A – B,
где AB – начальное вещество, а A и B – ингредиенты, на которые оно будет разложено. Соответственно, X – это результат, представляющий собой два компонента A и B, по завершении реакции не реагирующие между собой.
Реакции замещения
Условия химических реакций с замещением тоже имеют свои особенности. Опираясь на простую математику, этот тип процессов можно описать следующим примером:
Допустим, что у нас есть некое соединение в виде двух компонентов «AB» и некое вещество «C». В данном представлении реакция замещения будет иметь вид:
AB + C = AC + B или AB + C = BC + A.
Иными словами происходит обычное замещение одного или нескольких компонентов на другой.
Реакции ионного обмена
Скорость химической реакции лучше всего пояснить на примере реакций ионного обмена, когда реагенты обмениваются ионами (заряженными частицами). В данном случае она может являться максимальной, поскольку преобразование одного вещества в другое происходит на молекулярном уровне. В математическом выражении такая формула имеет вид:
AB + CD = AD + CB (или в других вариациях).
По сути, реакции ионного обмена чем-то напоминают реакции замещения, хотя и отнесены к отдельному классу.
Окислительно-восстановительные реакции
Что касается реакций этого типа, то они являются из всех известных наиболее сложными (не говоря о реакциях синтеза). Дело в том, что даже составить обычное химическое уравнение с участием перманганата калия без специальных знаний просто не получится. Здесь нужно учитывать не только валентность каждой исходной составляющей, но и валентность, которую приобретают составляющие после окончания процесса. В большинстве случаев валентность может изменяться в достаточно широких пределах, а результатом реагирования двух начальных компонентов может стать образование трех или четырех соединений.
Факторы, влияющие на скорость химических реакций
Сама скорость химической реакции напрямую зависит от способности реагентов вступать в процесс, а также от некоторых дополнительных условий, например, температуры. Самым простым примером может послужить использование катализатора – вещества, способного ускорять ход химической реакции. Скажем, для ее замедления в некоторых случаях могут быть использованы вещества типа ингибиторов, адсорбентов, абсорбентов и т.д. Каждое такое вещество способно оказывать существенное воздействие на весь химический процесс и скорость его протекания.
Среди веществ этого типа обычному человеку знаком активированный уголь, способный впитывать кислоты или щелочи, в зависимости от среды, в которой он находится.

Заключение
Как видим, типы химических реакций для понимания обычным человеком достаточно просты. Самое главное в этом вопросе - четко себе уяснить, что представляет собой тот или иной процесс. Заметьте, в данном случае мы рассмотрели химические процессы на основе простой математики, не вдаваясь в подробности химии. Думается, именно такой подход поможет объяснить суть основных химических процессов, так сказать, «на пальцах». Более того, именно с точки зрения математики каждый и сможет понять, каковым на самом деле является тот или иной процесс.
В данном случае не рассматривались химические реакции и системы, в которых взаимодействует более двух реагентов. Для их понимания нужно обладать определенными знаниями. Только с ними можно будет составить то же уравнение, описывающее данный процесс, не говоря уже об органической химии, где для понимания того, что представляет собой какое-либо вещество, придется даже применять структурные формулы, скажем, на основе бензольного кольца или присоединяемых радикалов.
В данном случае отталкиваться приходится от обычных основ неорганической химии, которая и описывает большинство процессов наиболее просто и лаконично. Это верно, ведь на заре развития самой науки об органической никто и понятия не имел, тем не менее результаты открытий и многих исследований просто поражают воображение.
Похожие статьи
- Примеры химических и физических явлений в природе
- Гомогенные реакции: описание и примеры
- Эндотермическая реакция - это реакция с поглощением тепла
- Пластический обмен: характеристика, функции, этапы
- Химические реакции: изменчивый мир
- Химические свойства цинка и его соединений
- Электрохимическая коррозия и защита от нее
