Закон Авогадро: описание и биография учёного
Предвидеть результаты исследования, предугадать закономерность, почувствовать общие истоки – всем этим отмечено творчество большого числа экспериментаторов и учёных. Чаще всего прогноз распространяется лишь на область занятости исследователя. И мало у кого хватает смелости заняться долгосрочным прогнозированием, существенно опередив время. У итальянца Амедео Авогадро смелости было хоть отбавляй. Именно по этой причине данный учёный известен сейчас во всём мире. А закон Авогадро и по сей день используется всеми химиками и физиками планеты. В этой статье мы подробно расскажем о нём и его авторе.
Детство и учёба
Амедео Авогадро родился в Турине в 1776 году. Его отец Филиппе работал служащим в судебном ведомстве. Всего в семье было восемь детей. Все предки Амедео служили адвокатами при католической церкви. Молодой человек также не отступил от традиции и занялся юриспруденцией. К двадцати годам он уже имел степень доктора.
Со временем юридическая практика перестала увлекать Амедео. Интересы молодого человека лежали в другой сфере. Ещё в юности он посещал школу экспериментальной физики и геометрии. Тогда в будущем учёном и проснулась любовь к наукам. Из-за пробелов в знаниях Авогадро занялся самообразованием. В 25 лет Амедео всё свободное время уделял изучению математики и физики.
Научная деятельность
На первом этапе научная деятельность Амедео была посвящена изучению электрических явлений. Интерес Авогадро особо усилился после того как Вольт открыл источник электрического тока в 1800 году. Не менее интересны молодому учёному были дискуссии Вольта и Гальвани о природе электричества. Да и в целом тогда данная область была передовой в науке.
В 1803 и 1804 годах Авогадро вместе с братом Феличе представил учёным из Туринской Академии две работы, раскрывающие теории электрохимических и электрических явлений. В 1804 году Амедео стал членом-корреспондентом данной академии.
В 1806 году Авогадро устроился репетитором в Туринский лицей. А спустя три года учёный перебрался в лицей Верчелли, где преподавал математику и физику на протяжении десяти лет. В тот период Амедео прочитал много научной литературы, делая из книг полезные выписки. Он вёл их до конца жизни. Накопилось целых 75 томов по 700 страниц каждый. Содержание этих книг говорит о разносторонности интересов учёного и о том колоссальном труде, который он проделал.
Личная жизнь
Семейную жизнь Амедео устроил довольно поздно, когда его возраст уже перевалил за третий десяток. Работая в Верчелли, он встретил Анну ди Джузеппе, которая была намного моложе учёного. В этом браке родилось восемь детей. Никто из них не пошёл по стопам отца.
Закон Авогадро и его следствия
В 1808 году Гей-Люссак (в соавторстве с Гумбольдтом) сформулировал принцип объёмных отношений. Этот закон гласил, что соотношение между объёмами реагирующих газов можно выразить простыми числами. Например, 1 объём хлора, соединяясь с 1 объёмом водорода, даёт 2 объёма хлороводорода и т.п. Но данный закон ничего не давал, так как, во-первых, не было конкретного различия между понятиями корпускула, молекула, атом, а во-вторых, у учёных были разные мнения насчёт состава частиц различных газов.
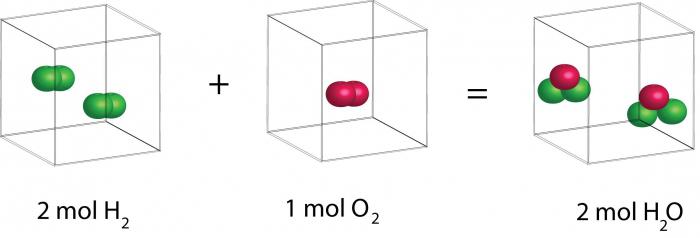
В 1811 году Амедео занялся тщательным анализом результатов исследований Гей-Люссака. В итоге Авогадро понял, что закон объёмных отношений позволяет понять устройство молекулы газов. Гипотеза, которую он сформулировал, гласила: «Число молекул любого газа в одном и том же объёме всегда одинаково».
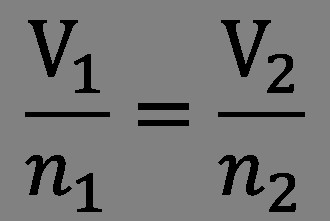
Открытие закона
Целых три года учёный продолжал экспериментировать. И в итоге появился закон Авогадро, который звучит так: «Равные объёмы газообразных веществ при одинаковой температуре и давлении содержат одинаковое количество молекул. А меру массы молекул можно определить по плотности различных газов». Например, если 1 литр кислорода содержит столько же молекул, сколько и 1 литр водорода, то отношение плотностей данных газов равно отношению массы молекул. Также учёный отметил, что молекулы в газах не всегда состоят из одиночных атомов. Допустимо наличие как разных, так и одинаковых атомов.
К сожалению, во времена Авогадро данный закон нельзя было доказать теоретически. Но он давал возможность устанавливать в экспериментах состав молекул газов и определять их массу. Давайте проследим логику подобных рассуждений. В ходе эксперимента было выявлено, что пары воды из газа, а также объёмы водорода и кислорода соотносятся в пропорции 2:1:2. Из этого факта можно сделать разные выводы. Первый: молекула воды состоит из трёх атомов, а молекулы водорода и кислорода из двух. Вполне уместен и второй вывод: молекулы воды и кислорода двухатомны, а водорода – одноатомны.
Противники гипотезы
У закона Авогадро было много противников. Отчасти это было связано с тем, что в те времена отсутствовала простая и ясная запись уравнений и формул химических реакций. Главным недоброжелателем был Йенс Берцелиус – шведский химик, имеющий непререкаемый авторитет. Он считал, что у всех атомов есть электрические заряды, а сами молекулы состоят из атомов с противоположными зарядами, которые притягиваются друг к другу. Так, у атомов водорода был положительный заряд, а у атомов кислорода – отрицательный. С этой точки зрения молекулы кислорода, состоящей из 2-х одинаково заряженных атомов, просто не существует. Но если молекулы кислорода всё же одноатомны, то в реакции азота с кислородом пропорция соотношения объёмов должна быть 1:1:1. Данное утверждение противоречит эксперименту, где из 1 литра кислорода и 1 литра азота получали 2 литра оксида азота. Именно по этой причине Берцелиус и другие химики отвергали закон Авогадро. Ведь он абсолютно не соответствовал экспериментальным данным.

Возрождение закона
До шестидесятых годов девятнадцатого столетия в химии наблюдался произвол. Причём он распространялся как на оценку молекулярных масс, так и на описание химических реакций. Об атомном составе сложных веществ было вообще много неверных представлений. Некоторые учёные даже планировали отказаться от молекулярной теории. И только в 1858 году химик из Италии по имени Канниццаро нашёл в переписке Бертолле и Ампера ссылку на закон Авогадро и следствия из него. Это упорядочило запутанную картину химии того времени. Два года спустя Канниццаро рассказал о законе Авогадро в Карлсруэ на Международном конгрессе по химии. Его доклад произвёл на учёных неизгладимое впечатление. Один из них сказал, что он как будто прозрел, все сомнения испарились, а взамен появилось чувство уверенности.
После того как закон Авогадро признали, учёные могли не только определять состав молекул газов, но и рассчитывать атомные и молекулярные массы. Эти знания помогали в расчёте массовых соотношений реагентов в различных химических реакциях. И это было очень удобно. Измеряя массу в граммах, исследователи могли оперировать молекулами.

Заключение
Много времени прошло с тех пор, как был открыт закон Авогадро, но об основоположнике молекулярной теории никто не забыл. Логика учёного была безупречной, что позже подтвердили расчёты Дж. Максвелла, основанные на кинетической теории газов, а затем и экспериментальные исследования (броуновское движение). Также было определено, сколько содержится частиц в моле каждого газа. Эта константа – 6,022•1023 была названа числом Авогадро, увековечив имя проницательного Амедео.
