Что такое ОВР (химия)? ОВР: примеры и решение
Что такое ОВР? Химия состоит из множества разделов, один из них рассматривает взаимодействия веществ, в результате которых у элементов (веществ) меняются показатели их степеней окисления. Рассмотрим основные термины, связанные с данной проблемой, приведем примеры взаимодействий.
Основные определения
В школьной программе рассматривается метод ОВР. Химия базируется на составлении баланса между количеством отданных (принятых) электронов. Окислителем является ион или атом, принимающий в процессе взаимодействия отрицательные частицы. Процесс, который при этом происходит, называется восстановлением. Восстановителем считают атомы или ионы, которые лишаются своих электронов, окисляясь при этом.

Значимость ОВР
Какое значение имеют ОВР? Химия располагает множеством примеров, когда данные превращения приводили к негативным последствиям. Например, до сих пор ученые не установили истинную причину разрушения статуи Колосса Родосского. Химики убеждены в том, что именно коррозия, которая является ОВР, стала причиной разрушения уникального памятника. В организме живых существ данные превращения обеспечивают обменные процессы.
Алгоритм разбора
Как правильно разбирать реакции ОВР? Химия школьного курса основывается на составлении электронного баланса между окислителем и восстановителем. Остановимся подробнее на последовательности действий школьников. Сначала необходимо поставить степени окисления у всех элементов, имеющихся в реакции. Для того чтобы успешно справиться с поставленной задачей, важно знать правила. Далее необходимо выявить те вещества, в которых после взаимодействия значения степеней окисления изменились.
При составлении электронного баланса, с помощью знака «плюс» показывают число принятых частиц, а «минусом» показывают количество отданных электронов. Между ними определяется наименьшее общее кратное, затем вычисляются индексы. Завершающим этапом будет расстановка коэффициентов в ОВР. Химия неорганических и органических веществ тесно связана с данным типом взаимодействий, к тому же задания предлагаются школьникам на выпускных испытаниях в 9 и 11 классах.
Первый пример
Разве ОВР - химия? Как решать такие задания? Данный вопрос является актуальным для ребят, которые выбрали предмет в качестве выпускного экзамена. На примере взаимодействия оксида железа (3) и угарного газа (оксида углерода (2)) рассмотрим последовательность действий.

Итак, дана схема Fe2O3 + CO → Fe + CO2, ее нужно рассмотреть как ОВР. ЕГЭ (химия) в 11 классе предполагает самостоятельное дополнение школьниками схемы недостающими веществами, но мы начнем с более простого задания, в котором уже даны все участники процесса. Как проверить, что это ОВР? Химия отвечает на этот вопрос посредством степеней окисления. Так как железо превращается из +3 в простое вещество с нулевым показателем степени окисления, а углерод повышает ее с +2 до +4, процесс является ОВР.
Баланс данного задания имеет следующий вид:
Fe(+3)+3e=Fe(0) 2
C(+2)-2e=C(+4) 3
Наименьшее общее кратное составляет 6. Железо является окислителем, угарный газ проявляет восстановительную способность. В готовом виде процесс имеет вид:
Fe2O3 + 3CO → 2Fe + 3CO2
Второй пример
ОВР в органической химии рассматривается по такому же алгоритму, есть только некоторые отличия в расстановке степеней окисления. Одно из заданий ЕГЭ посвящено вопросам, связанным с расстановкой коэффициентов в ОВР. Для успешного выполнения данного задания сначала школьники должны подумать, какие недостающие вещества им нужно вписать, и только после этого переходить к алгоритму разбора ОВР.

Например, с помощью электронного баланса необходимо составить уравнение:
PH3 + AgNO3 +… = Ag + HNO3
Для начала выявим, какое вещество пропущено в левой части данного взаимодействия. С учетом того, что серебро проявляет окислительные свойства, а фосфор будет восстановителем, недостающим веществом станет вода.
При составлении электронного баланса, получаем следующий вид:
P(-3) отдает 8 электронов = P(+5) 1
Ag(+) принимает электрон = Ag(0) 8
При расстановке коэффициентов, получаем запись процесса:
PH3 + 8 AgNO3 + 4H2O = 8Ag + 8HNO3 + H3PO4
PH3 - восстановитель, AgNO3 - окислитель
Третий пример
Воспользовавшись методом электронного баланса, решите уравнение:
Cr2 (SO4) 3 +…+ NaOH = Na2CrO4 + NaBr +…+ H2O
В данной схеме пропущено два вещества, поэтому сначала восстановим пробелы. Хром в данном процессе меняет степень окисления с +3 на +6, следовательно, им проявляются окислительные характеристики. Восстановитель в задании упущен, поэтому его функцию будет выполнять молекулярный бром. Среди продуктов реакции должна быть соль натрия, ею будет сульфат.
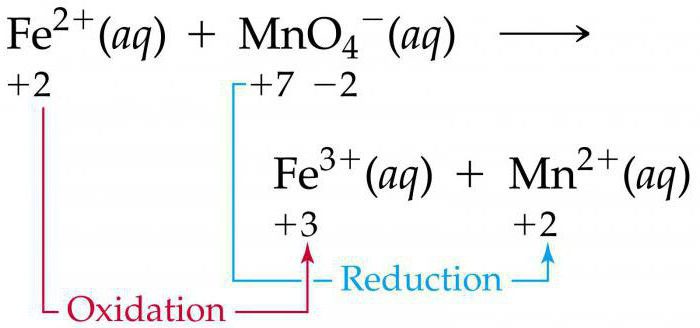
Электронный баланс для данного превращения имеет вид:
2Cr(+3) - 6e = 2Cr(+6) 1
Br2(0) + 2e = 2Br - 3
При расстановке в схеме коэффициентов учитываем, что атом натрия находится в составе нескольких веществ, поэтому его необходимо суммировать:
Cr2(SO4) 3+3 Br2 + 16NaOH = 2Na2CrO4 + 6 NaBr + 3Na2 SO4 + 8H2O
- Cr2(SO4) 3 является окислителем;
- Br2 выступает в роли восстановителя.
Четвертый пример
Воспользовавшись электронным балансом, решите уравнение:
KMnO4 + H2S + H2SO4 = S+ Mn SO4 +…+…
В задании есть два пропуска, причем оба вещества являются продуктами взаимодействия. Учитывая, что в данной схеме в качестве окислителя выступает марганец, а восстановительные свойства характерны для серы, степени окисления в пропущенных веществах остаются неизменными. Ими будет сульфат калия и вода.

Электронный баланс данного процесса:
Mn(+7) забирает 5 e = Mn(+2) 2
S(-2) отдает 2e = S(0) 5
Конечный вариант предлагаемой схемы ОВР имеет следующий вид:
2KMnO4 + 5H2S + 3H2SO4 = 5S + 2MnSO4 + 8H2O + K 2SO4
Перманганат калия проявляет окислительные свойства, сероводород является восстановителем.
Пятый пример
Заполните пропуски, расставьте коэффициенты в предложенной схеме превращений:
KMnO4 + H2SO4 + KBr = MnSO4 + Br2 +…+…
В данном взаимодействии окислительные параметры демонстрирует марганец, входящий в состав марганцовки. Бром, входящий в бромид калия, является восстановителем. Следовательно, среди продуктов реакции должны быть такие вещества, в которых не наблюдается изменений степеней окисления. Недостающими веществами будут выступать вода и сульфат калия. Процесс передачи электронов:
Mn(+7) принимает 5e = Mn(+2) 2
2Br(-) отдает 2e = Br2(0) 5
Расставим полученные коэффициенты в предложенную схему, получим следующее уравнение:
2KMnO4 + 8H2SO4 + 10KBr = 2MnSO4 + 5Br2 + 8H2O + 6K2SO4
- Перманганат калия - окислитель.
- Бромид калия - восстановитель.
Шестой пример
Воспользовавшись электронным балансом, поставьте коэффициенты в предложенной схеме превращений:
P + HNO3 = NO2 +…+…
Пропуски веществ даны в правой части. Чтобы выявить продукты, определяем окислитель и восстановитель. В левой части берется сильная кислота, поэтому в продуктах будет вода. Вторым пропущенным соединением будет являться фосфорная кислота.

Электронный баланс имеет вид:
P(0) отдает 5e = P(+5) 1
N(+5) принимает e = N(+4) 5
Приступаем к расстановке коэффициентов в уравнении:
P + 5HNO3 = 5NO2 + H2O + H3PO4
- Фосфор - восстановитель.
- Азотная кислота - окислитель.
Заключение
Разбор окислительных и восстановительных процессов методом электронного баланса является одним из тех заданий, которые вызывают серьезные проблемы у выпускников девятого и одиннадцатого классов. Именно поэтому важно отработать алгоритм действий, чтобы ребята успешно выполняли задания данного типа. Среди типичных ошибок, которые допускаются ребятами, выделим неправильную расстановку степеней окисления у элементов в сложных веществах.
Также довольно много проблем возникает при определении количества принятых и отданных атомами (ионами) электронов. Ребята неправильно определяют окислитель и восстановитель, допускают ошибки при расстановке коэффициентов в схеме уравнения. Задания, связанные с ОВР, считаются сложными, поэтому предполагают отработку порядка действий во внеурочной деятельности.
Похожие статьи
- Окислительно-восстановительный потенциал: расчет и измерение
- Дихромат калия: получение, применение, волшебные реакции с участием реагента
- Как решить задачи по химии: пошаговая инструкция для новичков
- Окислитель - это атом, принимающий электроны
- Как уравнять химическое уравнение: правила и алгоритм
- Пероксид водорода: свойства, получение, применение
- Как определить степень окисления атома химического элемента
