Протеолитические ферменты. Свойства ферментов. Действие протеолитических ферментов
Усвояемость пищи во многом зависит от качества ее переработки в организме человека. Переваривание пищи считается сложным процессом, в котором участвуют высокоактивные соединения белкового происхождения, способные ускорять процесс расщепления белковых, углеводных, липидных молекул до более мелких фрагментов.
Пищеварительные энзимы
Ферменты пищеварительной системы продуцируются клетками желез, секрет которых выделяется в пищеварительный тракт. Процесс расщепления сложных соединений является строго избирательным, поэтому существуют основные группы ферментов, способные воздействовать только на нуклеотидные, белковые, углеводные, жировые молекулы.
Действие пищеварительных ферментов
Ферменты пищеварительного тракта делятся на липазы, протеазы, амилазы, нуклеазы, нуклеотидазы.
Липазами называют ферменты, продуцируемые секреторными клетками в поджелудочной железе и желудке. Основное их назначение заключается в расщеплении липидов и поступлении их в кровь.
Амилазы служат для переваривания углеводных составляющих пищи, чтобы отдельные их фрагменты могли легко проникнуть в кровоток. К таким энзимам относят амилазу и мальтазу в слюне ротовой полости, лактазу в поджелудочном и кишечном соке.

Нуклеазы панкреатического секрета способны расщеплять кислоты нуклеиновые до нуклеотидов, а те в свою очередь под действием нуклеотидаз кишечного сока распадаются на нуклеозиды.
Ферментный состав слюны
В ротовой полости начинается процесс переваривания пищи, который связан с размачиванием сухих частиц слюной и первичным расщеплением углеводных составляющих. Ферменты слюны, в частности амилазы, оказывают воздействие на молекулы крахмала, превращая их в мальтозу. Жиры и белки пищи не подвергаются никаким химическим превращениям в полости рта.
Существуют и такие ферменты слюны, которые способны подвергать разрушению клеточную стенку вредоносных бактерий. Происходит это за счет гидролиза муреиновых структур оболочки. Именно поэтому слюна обладает бактерицидным действием.
Характеристика пищеварительных ферментов
Только соблюдение правильного питания и отсутствие вредных привычек позволит работать органам пищеварения в полную силу.
Подходящей температурой для нормального функционирования энзимов в организме является 36,6-37 градусов. Горячие блюда вызывают ожог слизистой оболочки в пищеводе и разрушение ферментных соединений. Происходит спазм гладких мышц желудочной стенки, вследствие чего неподготовленная пища поступает в 12-перстную кишку. Это приводит к расстройствам кишечника и всевозможным заболеваниям органов пищеварения.
Водородный показатель среды влияет на свойства ферментов, в частности на их активность. При разных концентрациях ионов водорода активные участки ферментного белка и субстрат ионизируются в разной степени.
Специфические свойства ферментов связаны с распознаванием химической структуры веществ, которые подвергаются расщеплению. Даже для двух изомеров одного вещества существуют свои энзимы.
Что такое протеолитические ферменты?
Протеазы являются гидролитическими ферментами, способными расщеплять связи пептидов и белков и восстанавливать полезные бактерии в кишечнике. Наличие химозина и пепсина в желудочном соке, химотрипсина, трипсина, эрепсина в кишечном секрете, карбоксипептидазы в панкреатическом соке говорит о разнообразии протеолитических ферментов.
Благодаря позиционной и субстратной специфичности этих энзимов происходит выбор участок разрыва в длинной пептидной цепочке гидролизуемой белковой или пептидной молекулы.
Протеолитические ферменты, в зависимости от места действия, бывают экзопептидазами, которые способны разрывать концевые связи, и эндопептидазами, осуществляющие гидролиз внутренних связей в белковой молекуле.
Пептидные связи на С- и N-конце белковой цепочки расщепляются карбоксипептидазой и аминопептидазой, относящимися к экзопептидазам. Существуют еще дипептидазы, разрывающие связь в дипептидах.
Эндопептидазы, в зависимости от структуры активного элемента, разделяются на:
- сериновые, в составе их активного центра содержится сериновый и гистидиновый остаток;
- цистеиновые, в составе их активного центра содержится SH-группа от цистеинового остатка;
- карбоксильные, в составе их активного центра содержится СООН-группа от остатка аспарагината;
- металлопротеиназу, в составе активного центра содержится ион металла.
На избирательность действия протеаз влияет аминокислотная структура остатков, их радикалы, пространственная конфигурация субстрата. Большинство протеаз реагируют на определенную структуру аминокислотных остатков, расположенных возле связи, которую разрывают. Например, трипсиновый фермент катализирует расщепление соединения между основными аминокислотами (лизином и аргинином), имеющими карбоксильную группу.
Протеолитические ферменты типа химотрипсина, пепсина реагируют на гидрофобный фенилаланиновый, тирозиновый, триптофановый и лейциновый остаток и разрывают возле них связи. Для действия эластазы поджелудочного сока важно наличие у аминокислотного остатка небольшого бокового ответвления, которые имеются у аланина и серина.
Структура протеолитических ферментов
Молекула протеазы представляет собой линейную цепочку из аминокислот, свернутую в глобулу и обладающую уникальным действием на белки. Поверхность протеолитических ферментов имеет впадину для связывания субстрата.
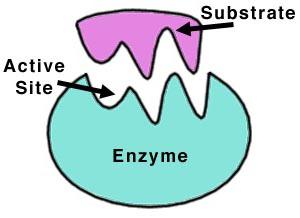
Несколько белковых цепочек могут объединяться в комплекс, а собранные таким образом глобулы образуют третичную структуру ферментов. Для активации многих протеаз кофакторами являются ионы Са2+ и Mg2+.
Существуют протеолитические ферменты, которые соединены с мембранной оболочкой клеток и воздействуют на определенную белковую структуру. Примером может служить сигнальная протеаза, ответственная за транспорт белковых молекул из клеток в межклеточную область.
Ингибирование протеолитических ферментов
Некоторые заболевания пищеварительной системы вызваны чрезмерной деятельностью протеаз, например, состояние острого панкреатита. Активаторами ферментов, продуцируемых поджелудочной железой, являются цитокиназы. С их помощью образуется трипсин из трипсиногена, происходят превращения проэластазы, калликреиногена, химотрипсиногена в активные формы ферментов. В результате их действия в поджелудочной железе наблюдается переваривание ткани собственным секретом, а затем отек и кровоизлияние этого органа.
Ингибиторы протеолитических ферментов направлены на подавление их ферментативной деятельности. Использование для внутривенных инъекций лекарственных средств на основе тразилола, пантрипина и контрикала позволяет снизить активность протеаз и снять воспалительные процессы в поджелудочной железе.
Острота заболевания во многом зависит от трипсин-ингибиторной системы. При достаточном содержании ингибиторного вещества происходит нейтрализация активированного фермента с восстановлением равновесия. Недостаток ингибитора приводит к дальнейшему развитию заболевания.
Роль протеаз
На многие процессы в организме человека влияет действие протеолитических ферментов. Без их участия не произойдет оплодотворение, свертывание белка крови, фибринолиз, биосинтез белковых молекул, иммунные реакции, гормональная регуляция.
Нарушение работы протеаз вызывает мышечную дистрофию, заболевания аутоиммунного характера, легочную эмфизему, воспаление поджелудочной железы.
На основе протеолитических ферментов разработан ряд препаратов, позволяющих корректировать пищеварение, заживлять ранения и ожоги.
Протеазы применяют для изготовления питания для парэнтерального введения, для производства препаратов на основе гормонов и антибиотических средств.
Получают ферменты из внутренних органов и желез животных (крупный рогатый скот и свиньи) и из растительного субстрата (плодовый латекс дынного дерева).
Похожие статьи
- Что такое ферменты? Роль ферментов в организме человека
- Что лучше, "Мезим" или "Панкреатин": состав, инструкция по применению и отзывы
- "Вобэнзим" в гинекологии: отзывы женщин и специалистов, инструкция по применению
- "Карипазим": инструкция по применению, показания, состав, аналоги, отзывы
- Ферменты для поджелудочной железы: препараты. Пищеварительные ферменты поджелудочной железы
- Что такое пептиды? Типы и виды пептидов
- Ферменты для пищеварения и последовательность их действий
