Гидратация алкенов: реакция и уравнения
Выясним, что представляет собой реакция гидратации алкена. Для этого дадим краткую характеристику данного класса углеводородов.
Общая формула
Алкены - это ненасыщенные органические соединения, имеющие общую формулу СпН2п, в молекулах которых есть одна двойная связь, а также присутствую одинарные (простые) связи. Углеродные атомы при ней находятся в sp2 гибридном состоянии. Представителей этого класса называют этиленовыми, так как родоначальником данного ряда является этилен.

Особенности номенклатуры
Для того чтобы понять механизм гидратации алкена, необходимо выделить особенности их наименования. Согласно систематической номенклатуре, при составлении названия алкена используют определенный алгоритм действий.
Для начала необходимо определить самую длинную углеродную цепочку, включающую двойную связь. Цифрами указывают расположение углеводородных радикалов, начиная с самого маленького в русском алфавите.
При наличии в молекуле нескольких одинаковых радикалов, в названии добавляют уточняющие приставки ди-, три-, тетра.
Только после этого называют саму цепочку из углеродных атомов, добавляя в конце суффикс -ен. Чтобы уточнить расположение в молекуле непредельной (двойной) связи, ее указывают цифрой. Например, 2метилпентен-2.

Гибридизация в алкенах
Чтобы справиться с заданием следующего типа: «Установите молекулярную формулу алкена, гидратацией которого получили вторичный спирт», необходимо выяснить особенности строения представителей этого класса углеводородов. Наличие двойной связи объясняет способность СхНу вступать в реакции присоединения. Угол между двойными связями составляет 120 градусов. По ненасыщенной связи не наблюдается вращения, поэтому для представителей этого класса характерна геометрическая изомерия. В качестве основного реакционного места в молекулах алкенов выступает именно двойная связь.
Физические свойства
Они аналогичны предельным углеводородам. Низшие представители данного класса органических углеводородов являются при нормальных условиях газообразными веществами. Далее наблюдается постепенный переход к жидкостям, а для алкенов, в молекулах которых содержится больше семнадцати атомов углерода, характерно твердое состояние. Все соединения этого класса имеют незначительную растворимость в воде, при этом они отлично растворяются в полярных органических растворителях.
Особенности изомерии
Присутствие в молекулах соединений ряда этилена объясняет многообразие их структурных формул. Помимо изомеризации углеродного скелета, характерной для представителей всех классов органических соединений, у них есть межклассовые изомеры. В их качестве выступают циклопарафины. Например, для пропена межклассовым изомером является циклопропан.
Присутствие в молекулах данного класса двойной связи объясняет возможность геометрической цис- и транс- изомерии. Такие структуры возможны только у симметрических непредельных углеводородов, имеющих в составе двойную связь.
Существование данного варианта изомерии определяется невозможностью свободного вращения углеродных атомов по двойной связи.
Специфика химических свойств
Механизм гидратации алкена имеет определенные особенности. Данная реакция относится к электрофильному присоединению.
Как протекает реакция гидратации алкена? Чтобы ответить на данный вопрос, рассмотрим правило Марковникова. Суть его состоит в том, что гидратация алкенов несимметричного строения осуществляется определенным образом. Атом водорода будет присоединяться к тому углероду, который более гидрогенизирован. Гидроксильная группа присоединяется к углеродному атому, у которого меньше Н. Гидратация алкенов приводит к образованию вторичных одноатомных спиртов.
Для того чтобы реакция протекала в полном объеме, в качестве катализаторов используют минеральные кислоты. Они гарантируют ввод в реакционную смесь необходимого количества катионов водорода.
Гидратацией алкенов нельзя получить первичные одноатомные спирты, поскольку не будет соблюдаться правило Марковникова. Данная особенность используется в органическом синтезе вторичных спиртов. Любая гидратация алкенов осуществляется без использования жестких условий, поэтому процесс нашел свое практическое использование.
Если в качестве исходного представителя класса СпН2п берут этилен, правило Марковникова не работает. Какие спирты нельзя получить гидратацией алкенов? Невозможно получить в результате такого химического процесса первичные спирты из несимметричных алкенов. Как используется гидратация алкенов? Получение спиртов вторичного вида осуществляется именно таким способом. Если в качестве углеводорода выбирается представитель ряда ацетилена (алкины), гидратация приводит к получению кетонов и альдегидов.

По правилу Марковникова осуществляется гидратация алкенов. Реакция имеет механизм электрофильного присоединения, суть которого хорошо изучена.
Приведем несколько конкретных примеров подобных превращений. К чему приводит гидратация алкенов? Примеры, предлагаемые в школьном курсе химии, свидетельствуют о том, что из пропена можно получить при взаимодействии с водой пропанол-2, а из бутена-1 получают бутанол-2.
В промышленных объемах используется гидратация алкенов. Спирты вторичного состава получают именно таким способом.

Галогенирование
Качественной реакцией на двойную связь считается взаимодействие непредельных углеводородов с молекулами галогенов. Мы уже проанализировали, как происходит гидратация алкенов. Механизм галогенирования аналогичен.
Молекулы галогенов имеют ковалентную неполярную химическую связь. При проявлении временных флуктуаций у каждой молекулы возникает электрофильность. В результате вырастает вероятность протекания присоединения, сопровождающегося разрушением двойной связи в молекулах ненасыщенных углеводородов. После завершения процесса продуктом реакции является дигалогенпроизводное алкана. Бромирование считают качественной реакцией на непредельные углеводороды, поскольку происходит постепенное исчезновение бурой окраски галогена.

Гидрогалогенирование
Мы уже рассмотрели, какова формула гидратации алкенов. Аналогичный вариант имеют и реакции взаимодействия с бромоводородом. В данном неорганическом соединении ковалентная полярная химическая связь, поэтому происходит смещение электронной плотности к более электроотрицательному атому брома. Водород приобретает частичный положительный заряд, отдавая галогену электрон, атакует молекулу алкена.
Если непредельный углеводород имеет несимметричное строение, при его взаимодействии с галогеноводородом происходит образование двух продуктов. Так, из пропена при гидрогалогенировании получают 1-бромпроан и 2-бромпропан.
Для предварительной оценки вариантов взаимодействия учитывают электроотрицательность выбираемого заместителя.
Окисление
Двойная связь, присущая молекулам непредельных углеводородов, подвергается воздействию сильных окислителей. Они также имеют электрофильный характер, применяются в химической промышленности. Особый интерес представляет окисление алкенов водным (либо слабощелочным) раствором перманганата калия. Ее называют реакцией гидроксилирования, так как в итоге получают двухатомные спирты.
Например, при окислении молекул этилена водным раствором перманганата калия получают этиндиол-1,2 (этиленгликоль). Это взаимодействие считают качественной реакцией на двойную связь, так как в ходе взаимодействия наблюдается обесцвечивание раствора перманганата калия.
В кислой среде (при жестких условиях) среди продуктов реакции можно отметить альдегид.
При взаимодействии с кислородом воздуха наблюдается окисление соответствующего алкена до углекислого газа, водяного пара. Процесс сопровождается выделением тепловой энергии, поэтому в промышленности его используют для получения тепла.
Наличие двойной связи в молекуле алкена свидетельствует о возможности протекания у данного класса реакций гидрирования. Взаимодействие СпН2п с молекулами водорода происходит при термическом использовании в качестве катализаторов платины, никеля.
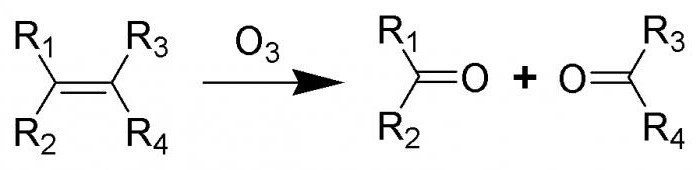
Многие представители класса алкенов склонны к озонированию. При невысоких температурах представители данного класса реагируют с озоном. Процесс сопровождается разрывом двойной связи, образованием циклических перекисных соединений, именуемых озонидами. В их молекулах присутствуют связи О-О, поэтому вещества являются взрывоопасными веществами. Озониды не синтезируют в чистом виде, их разлагают, используя процесс гидролиза, затем восстанавливают с помощью цинка. Продуктами такой реакции выступают карбонильные соединения, выделяемые и идентифицируемые исследователями.
Полимеризация
Данная реакция предполагает последовательное объединение нескольких молекул алкена (мономеров) в крупную макромолекулу (полимер). Из исходного этена получают полиэтилен, имеющий промышленное применение. Полимером называют вещество, которое имеет высокую молекулярную массу.
Внутри макромолекулы располагается определенное количество повторяющихся фрагментов, называемых структурными звеньями. Для полимеризации этилена в качестве структурного звена рассматривается группа - СН2—СН2-. Степень полимеризации показывает количество звеньев, повторяющихся в структуре полимера.
Степень полимеризации определяет свойства полимерных соединений. Например, полиэтилен с короткими цепями представляет собой жидкость, имеющую смазочные свойства. Для макромолекулы с длинными цепями свойственно твердое состояние. Гибкость и пластичность материала применяют в изготовлении труб, бутылок, пленок. Полиэтилен, в котором степень полимеризации составляет пять-шесть тысяч, обладает повышенной прочностью, поэтому применяется при производстве прочных нитей, жестких труб, литых изделий.
Среди продуктов, получаемых путем полимеризации алкенов, имеющих практическое значение, выделим поливинилхлорид. Данное соединение получают путем полимеризации винилхлорида. Получаемый продукт имеет ценные эксплуатационные характеристики. Он отличается повышенной стойкостью к воздействию агрессивных химических веществ, негорюч, легко поддается окрашиванию. Что можно изготовить из поливинилхлорида? Портфели, плащи, клеенку, искусственную кожу, кабели, изоляцию электрических проводов.
Тефлон является продуктом полимеризации тетрафторэтилена. Данное органическое инертное соединение устойчиво к резким перепадам температур.
Полистирол представляет собой упругое прозрачное вещество, образуемое путем полимеризации исходного стирола. Он незаменим при изготовлении диэлектриков в радио- и электротехнике. Кроме того, полистирол в большом количестве применяется для производства кислотоупорных труб, игрушек, расчесок, пористых пластмасс.
Особенности получения алкенов
Представители данного класса востребованы в современной химической промышленности, поэтому были разработаны разнообразные способы их промышленного и лабораторного получения. В природе этилен и его гомологи не существуют.
Многие лабораторные варианты получения представителей данного класса углеводородов связаны с реакциями, обратными присоединению, именуемые отщеплением (элиминированием). Например, при дегидрировании парафинов (предельных углеводородов) получают соответствующие алкены.
При взаимодействии галогенпроизводных алканов с металлическим магнием также можно получить соединения с общей формулой СпН2п. Элиминирование осуществляется по правилу Зайцева, обратному правилу Марковникова.
В промышленных объемах непредельные углеводороды ряда этилена получают путем крекинга нефти. В газах крекинга и пиролиза нефти и газа содержится от десяти до двадцати процентов непредельных углеводородов. В смеси продуктов реакции находятся и парафины, и алкены, которые отделяют друг от друга путем фракционной перегонки.
Некоторые области применения
Алкены являются важным классом органических соединений. Возможность их применения объясняется отличной реакционной способностью, простотой получения, приемлемой стоимостью. Среди многочисленных промышленных отраслей, использующих алкены, выделим полимерную промышленность. Огромное количество этилена, пропилена, их производных уходит на изготовление полимерных соединений.
Именно поэтому так актуальны вопросы, касающиеся поиска новых путей производства алкеновых углеводородов.
Поливинилхлорид считается одним из важнейших по применению продуктов, получаемых из алкенов. Для него характерна химическая и термическая устойчивость, незначительная горючесть. Поскольку данное вещество не растворяется в минеральных, но растворимо в органических растворителях, его можно использовать в разных промышленных отраслях.
Его молекулярная масса составляет несколько сотен тысяч. При повышении температуры вещество способно к разложению, сопровождаемому выделением хлороводорода.
Особый интерес представляют его диэлектрические свойства, используемые в современной электротехнике. Среди отраслей промышленности, в которых применяют поливинилхлорид, выделим изготовление искусственной кожи. Получаемый материал по эксплуатационным характеристикам ничуть не уступает натуральному материалу, при этом имеет гораздо меньшую стоимость. Одежда из такого материала становится все более популярной у модельеров, создающих яркие и красочные коллекции молодежной одежды из поливинилхлорида разного цвета.
В больших количествах поливинилхлорид применяют в качестве уплотнителя в холодильниках. Благодаря эластичности, упругости это химическое соединение востребовано при изготовлении пленок и современных натяжных потолков. Моющиеся обои дополнительно покрывают тонкой пленкой ПВХ. Это позволяет добавить им механическую прочность. Такие отделочные материалы станут идеальным вариантом для проведения косметического ремонта в офисных помещениях.
Кроме того, гидратация алкенов приводит к образованию первичных и вторичных одноатомных спиртов, которые являются отличными органическими растворителями.
Похожие статьи
- Физические свойства алкенов, применение, способы получения
- Углеводороды - это соединения углерода с водородом, не содержащие других элементов. Классификация углеводородов
- Алкены: номенклатура и строение
- Непредельные алкены: формула, свойства, применение
- Химические свойства алкадиенов - непредельных углеводородов
- Алкины: получение и применение
- Чем знаменит Кучеров? Реакция гидратации алкинов
