Что такое электролиз в химии?
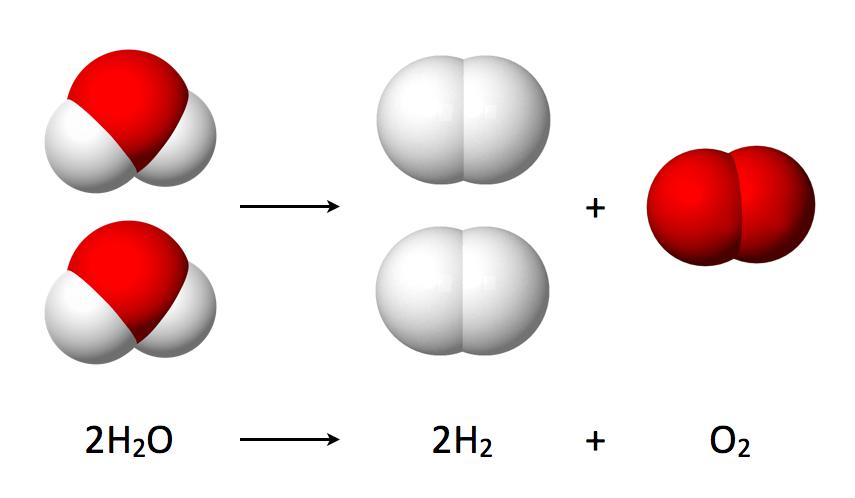
Для начала попробуем понять, что такое электролиз. Это химические реакции, которые протекают под воздействие электрического тока на электродах, которые помещены в расплав либо раствор электролита.
Некоторые теоретические понятия
Электролитом называют вещество, которое проводит ток. Электроды бывают двух видов. Катод представляет собой заряженный отрицательно электрод, на нем происходит реакция восстановления.
Анодом называют положительно заряженный электрод, где осуществляется восстановление.
Использование процесса
Электролиз растворов используется в разных отраслях современной промышленности. В химической отрасли с помощью данного процесса получают хлор, щелочи, перхлораты, хлораты, персульфаты, органические вещества, перманганат калия, надсерную кислоту, фтор, кислород, водород, иные ценные продукты.
В цветной металлургии электролиз расплавов применяют для извлечения чистого металла из руд. Металлы, которые нельзя выделять из-за высокого отрицательного потенциала из водных растворов, в цветной металлургии получают электролизом расплавов. Среди металлов, которые получают путем электролиза так называемых расплавленных сред, отметим магний, алюминий, уран, бериллий, цирконий.
Электролиз используют в машиностроении, электронной промышленности, радиотехнике, полиграфии, чтобы наносить тонкие металлические покрытия на изделия, защищая их от коррозии, увеличивая износостойкость, повышая жаропрочность.

Историческая справка
Что такое электролиз? Это одно из важнейших направлений в электрохимии. Зародилась наука на рубеже 18-19 веков. Именно в тот период были проведены опыты итальянским физиологом Л. Гальвани и физиком А. Вольтом. В конце 18 века появились первые химические источники тока. В начале 20 века электрохимия начала заниматься изучением электрохимических процессов. Экспериментальным путем было установлено, что электрический ток, проходя через водные растворы солей, вызывает химические превращения, приводящие к образованию новых соединений.
Рассуждая над тем, что такое электролиз, отметим, что он является сложной совокупностью процессов: миграции ионов, диффузии, электрохимических реакций разряда ионов, вторичных химических реакций продуктов электролиза друг с другом.
Классификация процессов
Говоря о том, что такое электролиз, необходимо остановиться на классификации электролитических процессов. Их делят на:
- получение неорганических соединений (хлора, кислорода, водорода);
- образование металлов (магния, меди, алюминия, калия, натрия, бериллия, серебра, меди);
- получение металлических и гальванических покрытий;
- азотирование, электрическая полировка, борирование поверхности металла;
- нанесение с помощью электрофореза пленок;
- обессоливание и электродиализ воды;
- производство разнообразных органических веществ.
Эксперименты с электролизом
Как составить уравнение электролиза? Данный процесс протекает в электролитах. Можно соединить с двумя угольными электродами провода, которые идут от осветительной сети.
В один из них включить электрическую лампу, которая станет подтверждением присутствия в цепи электрического тока. Свободные концы электродов можно разместить в сухой поваренной соли либо безводной серной кислоте.
Лампа не горит, поскольку вещества не способны проводить электрический ток, и цепь остается разомкнутой. Аналогичный результат наблюдается и в том случае, когда электроды погружаются в стакан с дистиллированной водой.
При растворении в воде небольшого количества поваренной соли, щелочи, кислоты наблюдается яркое свечение лампы.
При опускании в раствор глицерина либо сахара электродов лампа также перестает светиться.
Данный эксперимент, безусловно, подтверждает проводимость солями, основаниями, растворами кислот электрического тока.
При прохождении электрического тока через растворы либо расплавы наблюдаются химические изменения, которые выражаются в выделении продуктов разложения растворителя либо растворенного вещества.

Что собой представляет процесс в случае с поваренной солью
В ходе экспериментальных наблюдений было отмечено, что электролиз водного раствора хлорида натрия приводит к образованию на катоде водорода, выделению газообразного хлора на аноде. Как математически описать данный процесс? Электролиз натрия хлористого происходит в расплаве, приводит к появлению на катоде чистого щелочного металла, а на аноде – газообразного хлора.
... и хлоридом магния
После прохождения эклектического тока через расплав хлорида магния, наблюдается появление катионов магния и анионов хлора.
На катоде наблюдается восстановление катионов магния до чистого металла, Анионы хлора, направляющиеся к аноду, отдают электроны, происходит процесс окисления. Электролиз хлорида магния можно записать суммарным уравнением:
MgCl2 = Mg + Cl2
Особенности электролиза в растворах
Важно учитывать тот факт, что, помимо ионов электролита, есть также в растворе и продукты диссоциации воды: катионы водорода и анионы гидроксильной группы. Именно поэтому у катода возможна разрядка и катиона электролита, и протона водорода. У анода осуществляется разрядка гидроксильных ионов и анионов электролита.

Также молекулы воды вполне могут подвергаться электрохимическому восстановлению или окислению.
При тщательном рассмотрении катодных процессов, которые протекают в ходе электролиза водного раствора, важно учитывать величину потенциала восстановления протонов водорода. Он зависит от концентрации катионов водорода, имеющего значение -0, 41 В.
Если в растворе электролита присутствует металл, у которого электродный потенциал имеет более положительное значение, следовательно, у катода в рамках электролиза будет наблюдаться его восстановление. Это утверждение относится к тем металлам, которые в электрохимическом ряду напряжений Бекетова располагаются вблизи водорода. При более отрицательном значении электродного потенциала, чем у катионов водорода, металл не будет восстанавливаться на катоде. В таких случаях на данном электроде скапливается водород.
При значении потенциала металла, сходном с показателем -0,41 В, допустимо одновременное образование на катоде как водорода, так и чистого металла .
На характер катодного процесса в случае электролиза раствора соли (щелочи) влияет расположение металла в ряду электрохимических напряжений металлов Бекетова.
При анализе процессов, протекающих на аноде, необходимо учитывать тот факт, что возможно окисление материала анода. Именно поэтому в электрохимии выделят инертный анод, а также электрод, состоящий их активного анода.
Инертным является тот анод, у которого в рамках протекающего электролиза материал не подвергается окислению. Активным считают анод, способный окисляться в ходе электролиза.
Для инертных анодов выбирают платину, уголь, графит. Именно этот вариант рассматривается в школьном курсе химии.

Типичные примеры электролиза водных растворов
Начнем с особенностей протекания электролиза в растворе хлорида меди (2). Так как данный металл в электрохимическом ряду активности металлов располагается правее водорода, на катоде происходит образование металлической меди. В анодном пространстве разряжаются хлорид-ионы, образуя газообразный хлор. Схему процесса представим в следующем виде:
- Катод: Cu2+ 2e = Cu.
- Анод: 2Cl--2 e = Cl2.
Суммарное уравнение:
- CuCl2 = Cu+ Cl2.
Как выглядит электролиз водного раствора сульфата натрия? Так как натрий располагается в ряду активности металлов левее водорода, то на катоде наблюдается образование молекулярного водорода. Кроме того, в прикатодном пространстве накапливаются гидроксид-ионы.
У анода происходит выделение газообразного кислорода, а вблизи данного электрода скапливаются гидроксид-ионы.
Так как в растворе остаются катионы натрия и сульфат-ионы, данная часть раствора остается электрически нейтральной. Схему такого электролиза можно представить в следующем виде:
- 2Na2SO4 + 6H2O = 4NaOH + 2H2SO4 + O2 + 2H2

Факторы, влияющие на процесс электролиза
Результативность данной химической реакции оценивается несколькими факторами, среди которых можно отметить: напряжение, силу тока, выход по току, коэффициент полезного действия, расход электрической энергии на единицу образующегося продукта, плотность тока.
Сила тока характеризует производительность электролизера. И чем она выше, тем большее количество продукта образуется на электродах.
Выход по току позволяет учитывать результативность применения количества электрического тока, пропущенного через электролизер.
Похожие статьи
- Женские интимные прически: фото, виды и технология выполнения
- Интересные темы для проекта. Проектная деятельность школьников
- Первопечатник Иван Федоров: биография краткая для детей
- Миф о Геракле: краткое содержание. 12 подвигов Геракла
- Теория вероятности: формулы и примеры решения задач
- Закрыть гештальт - что это? Значение и особенности
- Простое предложение. Виды простых предложений
