Изменение внутренней энергии идеального газа
Физику газового состояния материи начинают изучать на примере свойств идеального газа. Для него существует два важных уравнения, которые позволяют связать макроскопические термодинамические характеристики и запасенную в газе энергию. Представленную статью посвятим подробному ответу на вопрос, как определить внутреннюю энергию изменение идеального газа.
О каком газе пойдет речь?

Что понимают в физике под термином "идеальный газ"? Очевидно, что речь идет о текучей субстанции, которая не способна сохранять свою форму и объем при минимальных внешних воздействиях на нее. Под словом "идеальный" понимают тот факт, что частицы, составляющие газовую систему, не взаимодействуют друг с другом. Их кинетическая энергия настолько велика, что потенциальную энергию связи можно не учитывать при выполнении расчетов.
Кроме того, концепция идеального газа предполагает пренебрежение размерами газовых частиц по сравнению с расстояниями между ними. Такие малые размеры свидетельствуют об отсутствии столкновений между частицами. Тем не менее частицы сталкиваются со стенками содержащего газ сосуда. При этом создается внутреннее давление. Эти столкновения являются абсолютно упругими (сохранение импульса и кинетической энергии).
Резюмируя сказанное выше, можно отметить, что газ, который состоит из химически пассивных молекул и атомов, имеет низкое давление (плотность) и высокую температуру, с высокой степенью точности справедливо полагать идеальным. Близкими к идеальному являются благородные газы (гелий, неон, ксенон) и воздух, а вот водяной пар нельзя считать идеальным, поскольку между молекулами воды существуют сильные водородные связи.
Понятие об энергии (внутренней)
Внутренняя энергия - это та энергия, которая находится или запасена внутри системы. В общем случае она равна сумме кинетической энергии всех движущихся и колеблющихся частиц системы и потенциальной энергии взаимодействия. Применяя это определение к идеальному газу, можно отметить, что его внутренняя энергия точно равна только кинетической составляющей (взаимодействие между частицами отсутствует), то есть справедливо следующее выражение:
U = Ek.
Для полноты информации о внутренней энергии U приведем общее выражение для нее из термодинамики:
U = H - P * V.
Где P, V - давление и объем, H - энтальпия.
Газ идеальный и его внутренняя энергия
Прежде чем рассматривать процесс изменения внутренней энергии идеального газа, получим формулу для этой величины. Поскольку рассматриваемая субстанция не обладает потенциальной энергией, нам достаточно вычислить кинетическую всех газовых частиц. Это позволяет получить формулу для U. С температурой кинетическая средняя энергия одной частицы связана таким выражением:
1 / 2 * m * v2 = z / 2 * kB * T.
Здесь v - средняя скорость частицы (напомним, что в идеальных газах распределение скоростей частиц подчиняется законам Максвелла-Больцмана), kB - Больцмана постоянная, z - важное число, которое показывает количество степеней свободы у определенной газовой частицы.
Чтобы получить кинетическую энергию всей системы газовых частиц, необходимо умножить левую и правую части равенства на величину N (число частиц). Тогда получаем:
1 / 2 * m * N * v2 = z / 2 * kB * N * T.
Так как U и Ek равны, то формула энергии внутренней газа идеального примет вид:
U = z / 2 * kB * N * T.
Это выражение можно привести к более удобному виду (количество частиц N в системе трудно определить на практике). Чтобы это сделать, воспользуемся следующими выражениями:
n = N / NA;
R = kB * NA.
Откуда приходим к формуле для внутренней энергии через количество вещества n и универсальную газовую постоянную R (8,314 Дж/(моль*К)):
U = z / 2 * n * R * T.
Если вспомнить закон Менделеева-Клапейрона, то последнее равенство можно переписать еще в одном полезном для практики виде:
U = z / 2 * P * V.
Число степеней свободы и внутренняя энергия
Под числом z понимают количество возможных вариантов движения определенной газовой частицы. Так, для любой из них существует 3 степени свободы движения в трехмерном пространстве поступательного. Помимо них, для двухатомных молекул имеется возможность вращаться вокруг взаимно перпендикулярных двух осей, то есть для них z = 5. Если молекула более сложная (трех-, четырехатомная и так далее), то она вращаться может вокруг всех трех осей в пространстве, то есть для нее z = 6.
С учетом вышесказанного, можно записать следующие формулы для энергии внутренней:
U1 = 3 / 2 * n * R * T (одноатомный газ);
U2 = 5 / 2 * n * R * T (двухатомный газ);
U3 = 3 * n * R * T (многоатомный газ).
Процесс изотермический и ΔU
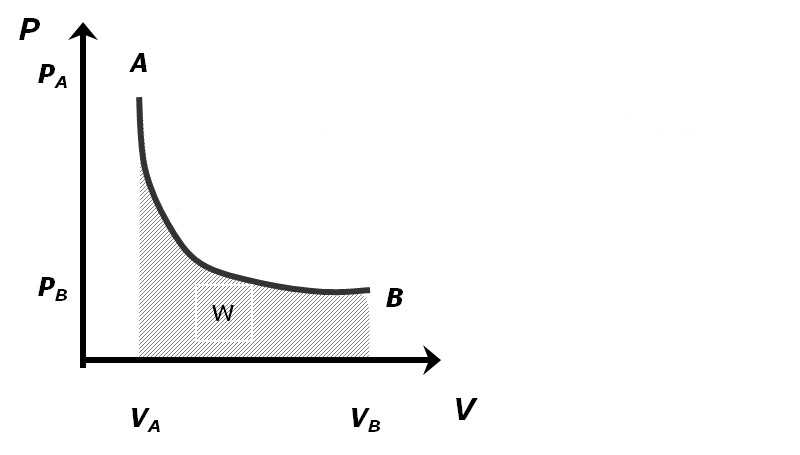
Изотермический процесс является одним из первых переходов газа из одного состояния в другое, который европейские ученые начали изучать еще в XVII веке. Изотермический процесс для идеального газа описывается так называемым законом Бойля-Мариотта, который математически выглядит так:
P * V = const при T = const.
Чтобы определить изменение внутренней энергии идеального газа, необходимо из ее конечного значения вычесть начальное, то есть:
ΔU = U2 - U1.
Подставляем формулу для U, приведенную в статье ранее, получаем:
ΔU = z / 2 * n * R * (T2 - T1) = 0.
Поскольку температура в ходе изотермического процесса поддерживается постоянной (T2 = T1), то равно нулю изменение внутренней энергии. Количество теплоты Q, сообщенное системе, полностью расходуется на совершение работы A газом.
Изобарный процесс и ΔU

В случае изобарного процесса в системе поддерживается постоянное давление. При этом температура и объем изменяются в прямой пропорциональности друг относительно друга. Этот изопроцесс описывается законом Шарля:
V / T = const при P = const.
В этом случае сообщенная системе энергия Q расходуется на работу и изменение внутренней энергии, то есть:
ΔQ = A + ΔU = P * ΔV + z / 2 * n * R * ΔT.
С учетом уравнения состояния Клапейрона-Менделеева можно записать такие формулы для ΔU в случае изобарного перехода между состояниями идеального газа:
ΔU = z / 2 * n * R * ΔT = z / 2 * P * ΔV.
Из этих равенств следует, что КПД одноатомного газа при изобарном расширении выше, чем КПД многоатомного газа. Однако даже для одноатомного газа большая часть энергии Q расходуется на увеличение энергии внутренней системы, чем на совершение ею работы. Последний факт легко показать, если взять отношение между величинами ΔU и A:
ΔU / A = 3 / 2 * P * ΔV / (P * ΔV) = 1,5.
КПД при изобарном расширении одноатомного идеального газа составляет:
КПД = A / Q = P * ΔV / (3 / 2 * P * ΔV + P * ΔV) * 100% = 40%.
Изохорный процесс и ΔU
Под изохорным процессом понимают такое изменение термодинамических параметров системы, при котором объем ее остается постоянным. Иными словами, при изохорном процессе изменяется давление в газовой системе и ее температура. Этот изопроцесс описывается законом Гей-Люссака. Это, как и предыдущие два изопроцесса, является частным случаем универсального уравнения Менделеева-Клапейрона. Закон Гей-Люссака математически записывают следующим образом:
P / T = const при V=const.
Какое изменение внутренней энергии происходит при этом процессе? Поскольку объем системы сохраняется, то работу она не совершает. Иными словами, все подводимое к ней количество теплоты идет на повышение ее внутренней энергии , то есть:
ΔU = Q = z / 2 * n * R * ΔT = z / 2 * V * ΔP.
Изохорный процесс является самым эффективным способом увеличения внутренней энергии (температуры) системы.
Похожие статьи
- Миф о Геракле: краткое содержание. 12 подвигов Геракла
- Что изучает история? Зачем нужно изучать историю? История мира
- Первопечатник Иван Федоров: биография краткая для детей
- К чему снятся змеи женщине? Толкование снов
- Расположение органов у человека (фото). Внутренние органы человека: схема расположения
- Закрыть гештальт - что это? Значение и особенности
- Какие бывают предложения по цели высказывания и по интонации? Виды предложений по цели высказывания
