Изохорный процесс идеального газа и закон Гей-Люссака. Пример решения задачи
Физика газов исследует различные процессы, которые происходят в системах с этими текучими субстанциями при изменении одного или нескольких термодинамических параметров. Одним из важных газовых законов является тот, что был открыт Гей-Люссаком для идеального газа. Он устанавливает математическое соотношение между давлением и температурой во время изохорного процесса. Рассмотрим этот вопрос подробнее в статье.
Что понимают под идеальным газом?
Идеальным называется такая газовая система, в которой атомы и молекулы движутся с большими скоростями, поэтому их кинетическая энергия намного превышает потенциальную. Кроме того, концепция идеального газа предполагает отсутствие у частиц линейных размеров. В действительности они, конечно же, имеют некоторые размеры, но они настолько малы по сравнению с межчастичными расстояниями, что ими пренебрегают без потери точности математического описания термодинамического состояния всей системы.
Любой реальный газ, как правило, считают идеальным, если он находится при небольших давлениях. При этом его температура близка или выше комнатной. Еще одним условием идеальности газа является инертность молекул, из которых он состоит.
Уравнение состояния
Прежде чем мы перейдем к изучению изохорного процесса идеального газа, полезно привести общее выражение, при помощи которого описывают термодинамическое состояние рассматриваемых текучих субстанций. Это выражение носит название универсального уравнения, или уравнения Клапейрона-Менделеева. Оно связывает три основных термодинамических параметра: T - температуру, P - давление, V - объем. Выражение имеет следующий простой вид:
P * V = n * R * T.
Оставшиеся два неописанных параметра - это n (количество вещества) и R (газовая универсальная постоянная, введенная Д. И. Менделеевым в это уравнение).
Заметим, что равенство позволяет описывать не только процессы в закрытых системах, но также в открытых (n ≠ const).
Закон Гей-Люссака и изохорный процесс в газе

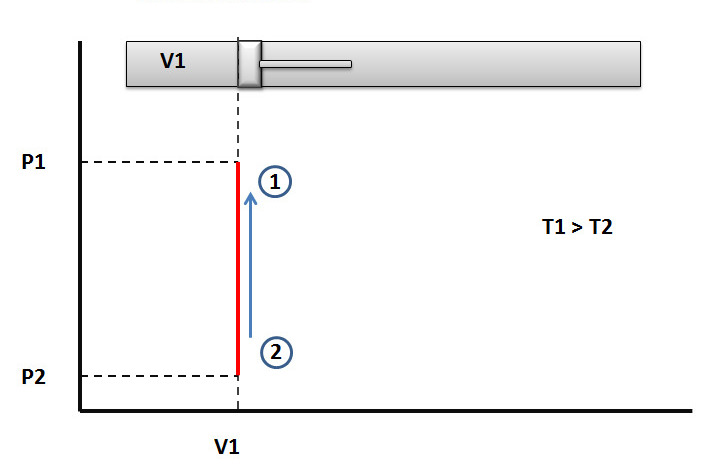
В начале XIX века, проводя опыты при постоянном объеме газовой системы, известный французский физико-химик Жозеф Гей-Люссак обнаружил экспериментально следующую зависимость между давлением и температурой:
P / T = const.
Ученый нагревал газ без изменения объема, измерял абсолютную температуру и наблюдал, что абсолютное давление увеличивается прямо пропорционально с возрастанием температуры. Наоборот, охлаждение постоянной массы газа в фиксированном объеме приводило к падению давления. При этом снова наблюдалась прямая пропорциональность между двумя параметрами.
Описанные выше опыты Гей-Люссака проводились в рамках так называемого изохорного процесса, то есть такого изменения состояний в системе, при котором объем остается постоянным. Постоянства объема добиться легко, если использовать сосуд, содержащий газ, с твердыми стенками.
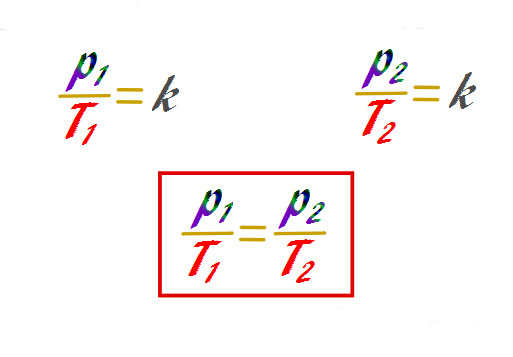
При решении задач по физике часто удобно записать закон Гей-Люссака в таком виде:
P1 / T1 = P2 / T2.
Где индекс указывает номер термодинамического состояния системы. Удобство такой записи заключается в возможности получить давление или температуру любого состояния через параметры другого состояния. Например:
T1 = T2 * P1 / P2.
С точки зрения кинетической теории газов объяснить возрастание давления при нагреве системы несложно. Когда увеличивается температура, то возрастает кинетическая энергия частиц. Последние с большей силой ударяют о стенки сосуда, а значит, создают большее давление на них.
Графическое представление процесса
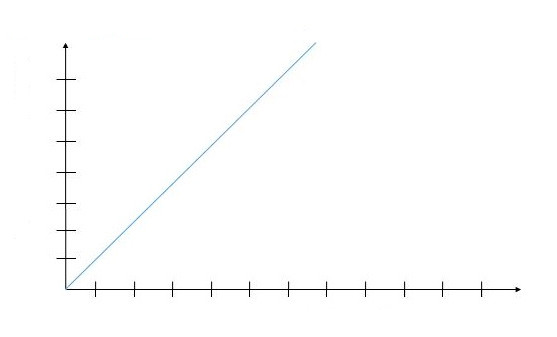
Графики в физике удобно использовать для предсказания поведения системы при разных условиях. Согласно закону Гей-Люссака, давление от температуры или температура от давления зависят линейно, то есть:
P = k * T.
Где k - постоянная величина для данной системы. Графиком функции P(T) будет прямая линия, которая начинается в начале координат. Наклонена она под углом α к оси абсцисс, при этом α = arctg(k). Прямая называется изохорой.
Если для того же количества вещества провести эксперимент с нагреванием при постоянном, но уже большем объеме, то график изохорного процесса наклонится ближе к оси абсцисс (ось температур). Наоборот, уменьшение объема при сохранении количества вещества в системе приведет к приближению линии к оси ординат (ось давлений).
Пример решения типовой задачи
Баллон с кислородом содержит газ под давлением 0,5 атмосферы и при температуре 300 К. Как изменится давление кислорода, если баллон нагреть до температуры 350 К? Как изменится график изохорного процесса, если сначала приоткрыть на некоторое время баллон, а затем нагреть его.
На первый вопрос ответить несложно. Запишем в соответствующем виде закон Гей-Люссака:
P1 / T1 = P2 / T2.
Откуда получаем:
P2 = P1 * T2 / T1 = 0,5 * 350 / 300 = 0,58 атм.
Таким образом, давление в баллоне возрастет на 0,08 атмосферы после его нагрева.
Отвечая на второй вопрос, следует сказать, что после приоткрывания баллона часть воздуха из атмосферы попадет в него, увеличив тем самым начальное давление в баллоне. При последующем нагреве новая изохора будет располагаться выше, чем старая, так как количество вещества в системе увеличилось.
Похожие статьи
- Где провести выпускной для 4 класса: интересные идеи и рекомендации
- Закрыть гештальт - что это? Значение и особенности
- Интересные темы для проекта. Проектная деятельность школьников
- Рассказ о моей семье на английском с переводом. Пример
- Первопечатник Иван Федоров: биография краткая для детей
- Мифы Древней Греции: краткое содержание и суть
- Подготовительная группа по физкультуре: что нельзя делать?
