Принцип Ле Шателье в химии
В некоторых случаях вещества, получающиеся в результате реакции, либо взаимодействуют между собой, либо распадаются, и тогда в системе одновременно протекают две реакции: прямая (образуются продукты реакции) и обратная (вновь синтезируются исходные вещества). В случае совпадения скоростей прямого и обратного процессов в рассматриваемой системе наступает равновесие, которое называется химическим. Это динамичное равновесие, поскольку сама реакция не прекращается, но образуется и распадается одновременно одинаковое количество вещества. При неизменных температуре и давлении такая ситуация может сохраняться довольно долго. В графическом виде она представлена ниже. Под эквивалентной скоростью подразумевается некая константа, равная одновременно скоростям прямой и обратной реакции.
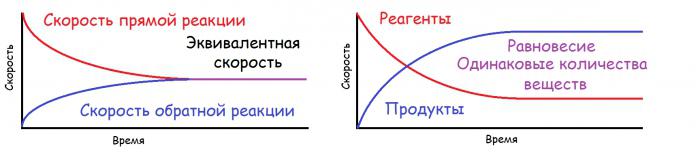
Принцип смещения химического равновесия
Принцип смещения (сдвига) равновесия открыл в 1884 году Ле Шателье. Позже его обобщил Карл Фердинанд Браун (1887 г.). Поэтому в настоящее время он носит сдвоенное название — принцип Ле Шателье-Брауна. Этот закон используется как в химии, так и в термодинамике, электродинамике, экологии и биохимии. Существует много формулировок, но суть каждой из них сводится к следующему: «При оказании на систему, находящуюся в равновесном состоянии, какого-либо воздействия, химическое равновесие смещается таким образом, чтобы компенсировать это изменение (т. е. система будет пытаться восстановить баланс)». Описываемый принцип можно наглядно продемонстрировать с помощью следующей системы. Имеется пружина, прикрепленная к неподвижной опоре. В состоянии покоя эта система находится в равновесии. Если пружину растянуть, то равновесие сместится в сторону внешнего воздействия. Однако при этом в системе также нарастает противодействие. И в какой-то момент силы противодействия и внешнего воздействия становятся равны друг другу, в результате чего наступает новое равновесное состояние.
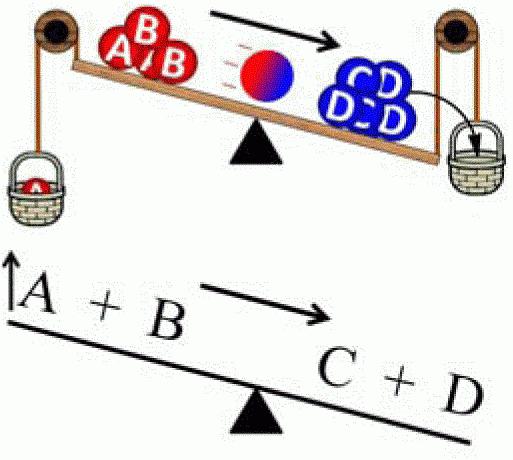
Принцип Ле Шателье можно использовать только для систем, находящихся в равновесии, в противном случае результаты анализа будут неверными. Существуют три основных параметра, изменение которых вызывает смещение химического равновесия: давление, температура и концентрация химических веществ.
Температура
Изменение температуры — наиболее частая причина сдвига химического равновесия, что вполне объяснимо, ведь на этот фактор повлиять намного легче, чем, например, на давление. Здесь следует упомянуть, что реакции разделяются на два типа по термическому эффекту. Среди них следующие: экзотермические (с выделением тепла) и эндотермические (с его поглощением). Как будет смещаться в данном случае химическое равновесие? Принцип Ле Шателье в этом случае сводится к следующему: с увеличением температуры равновесие смещается в сторону реакции, проходящей с поглощением тепла, а при её уменьшении, соответственно, в противоположную сторону. Так, если для реакции, изображённой ниже, повысить температуру, равновесие сдвинется в правую сторону.
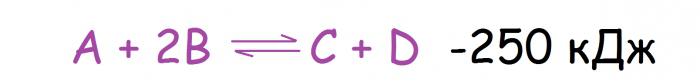
Большинство прямых реакций экзотермические, а обратных — эндотермические (это не правило, а, скорее, наблюдение, из которого можно найти множество исключений).
Давление
С изменением давления трансформируется следующий параметр системы — её объём (он увеличивается или уменьшается), поэтому воздействие с помощью этого параметра оказывает особенно сильное влияние на системы, в которых присутствуют газы. В этом случае принцип химического равновесия заключается в следующем. Если давление в системе увеличивается, то равновесие сдвигается в сторону сокращения числа молекул газа, а при уменьшении давления равновесие движется в противоположном направлении. Если число молекул газа во время реакции не изменяется, то равновесие не смещается при изменении давления, как, например, в следующей реакции.
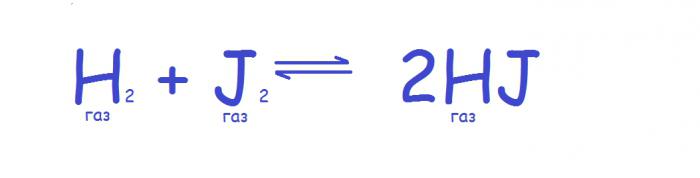
Однако на практике такой принцип верен лишь для идеальных газов, поскольку все реальные обладают разной сжимаемостью. Таким образом, даже если число молекул газа остаётся неизменным, равновесие может зависеть от давления. На практике это будет заметно при высоких давлениях. В случае жидких и твердых веществ изменение давления фактически не влияет на равновесие из-за малых объемов, занимаемых такими веществами. При рассмотрении смешанных систем учитывают только молекулы газа.
Смещение равновесия в системе в результате изменения концентрации любого вещества, участвующего в реакции
В ходе изменения концентрации какого-либо вещества принцип Ле Шателье работает следующим образом. При увеличении концентрации продуктов реакции равновесие смещается в сторону обратной реакции, при уменьшении количества образующихся веществ равновесие двигается в противоположную сторону.
Что будет, если добавить инертный газ
Изменить объем системы можно не только сжав ее или ослабив давление, но и путем добавления инертного газа, который не будет вступать в реакцию. Что будет с системой при добавлении в нее, например, гелия? На самом деле, скорее всего, ничего не произойдет, поскольку соотношение участвующих в реакции веществ не изменится, а для хода процесса имеет значение не общее давление системы, а парциальное каждого компонента.
Влияние катализаторов
На смещение химического равновесия количество катализатора и вообще его наличие влияния не оказывают. Это происходит ввиду того, что этот элемент одинаково ускоряет и прямую, и обратную реакцию, сохраняя равновесие в системе неизменным.
Способ изучения химического равновесия
Детальное рассмотрение химических равновесий очень важно для полного понимания процесса. Одним из наиболее часто применяемых приёмов является так называемый метод замораживания равновесий. Так, происходит быстрое охлаждение системы, находящейся в сбалансированном состоянии. Равновесие просто не успевает сместиться, а при низких температурах скорость большинства процессов замедляется практически до нуля. Благодаря этому можно полностью проанализировать состав смеси при любой температуре (концентрации веществ, участвующих в реакции, при нуле градусов будет соответствовать количеству компонентов при той температуре, с которой началось понижение). Такой опыт проводят несколько раз с реакциями, протекающими в обоих направлениях.
Существует ли полная необратимость
Полностью сдвинуть химическое равновесие в одну сторону невозможно. Даже при кажущемся абсолютном смещении всегда останется небольшое число молекул, которые будут вступать в обратную реакцию.

На практике фактически все реакции обратимы, а насколько сильно будет виден этот эффект, часто зависит от температуры (нередко равновесие просто сильно смещено в одно сторону, поэтому оно становится заметным лишь при смене условий). Именно из-за этой распространенности обратимых химических реакций изучение равновесия особенно важно.
Примеры синтезов, в которых во время производства смещается химическое равновесие
На производстве химическое равновесие обычно смещают в направлении прямой реакции для получения, соответственно, продуктов реакции. Существует множество примеров таких синтезов: получение аммиака, оксида серы (VI), оксида азота (II) и т. д.
Похожие статьи
- Экзотермическая реакция - это процесс, сопровождаемый выделением энергии
- Гидролиз солей. Какие соли подвергаются гидролизу
- Химическое равновесие и создание условий для его смещения
- Отель Les Pyramides 3*, Тунис, Хаммамет: отзывы
- Что такое обратимая реакция
- Эндотермическая реакция - это реакция с поглощением тепла
- ШИМ-регулятор. Широтно-импульсная модуляция. Схема
