Бензойная кислота: история открытия, свойства, получение, применение реактива
Самым обширным классом химических соединений считаются органические вещества. Их многообразие связано с уникальной способностью углерода создавать атомные цепочки, обладающие высокой стабильностью. Одним из представителей органических соединений, имеющих в составе бензольное кольцо, является бензойная кислота. Интересная история открытия, широкий спектр применения, способы получения, польза и вред вещества для человека будут описаны в данной статье.
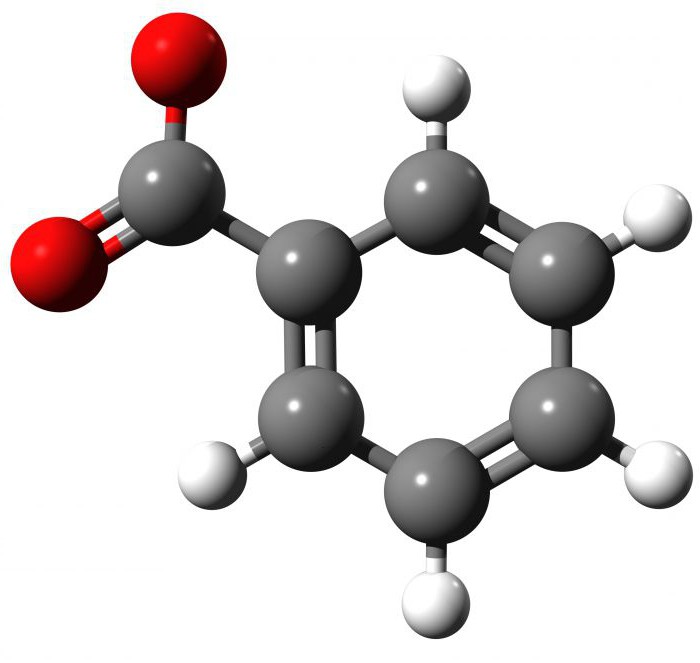
Описание, физические свойства соединения
При комнатной температуре бензойная кислота выглядит как белый порошок. Если рассмотреть его под микроскопом, вы увидите, что кристаллы имеют форму игл или чешуек (табличек). Соединение обладает резким специфическим запахом. Химическая формула этой карбоновой (органической) кислоты – C6H5COOH или C7H6O2. При нагревании до 122,4 ⁰C она начинает плавиться, а при 249 ⁰C - кипеть, дальнейшее повышение температуры до 370 ⁰C приведёт к термическому разложению. Нетрудно подсчитать молярную массу соединения, она составляет 122,12 грамм/моль. Реагент очень плохо растворяется в воде, а в этаноле и эфирах - хорошо. Реактив C6H5COOH является слабой кислотой, константа её диссоциации составляет 4,202.

Возгонка
Реактив легко поддаётся возгонке. При этом кристаллы сублимируются из паров, минуя жидкую фазу. Такой переход легко проследить при помощи опыта «зима в стакане» или «искусственный снег». Для этого в термостойкую химическую посуду помещают небольшое количество реагента и еловую веточку. Сверху располагают круглодонную колбу с водой, она послужит холодильником и крышкой. Конструкцию устанавливают на штатив и подвергают нагреванию. При этом реактив начинает возгоняться. Пары, достигая колбы с холодной водой, кристаллизуются и превращаются в «снег». Они оседают на еловой ветке и стенках стакана в виде тоненьких иголочек. Потрясающее зрелище! У него есть и практическое применение – сублимацию используют для получения и бензойной кислоты.
История открытия
Своё название бензойная кислота получила благодаря природному соединению, из которого впервые была выделена, – росному ладану. Этот процесс описан Нострадамусом в 1556 году, а чуть позже французским алхимиком Блезом де Виженером. Бензойная смола долгое время считалась единственным источником синтеза карбоновой кислоты, за что её и прозвали росноладанной. Большой вклад в исследование структуры и состава соединения внесли Ю. Либих и А. Кольбе. В 1875 году были изучены антисептические и антимикотические свойства бензойной кислоты. Открытие принадлежит немецкому физиологу Э. Л. Зальковскому. Это позволило применять реактив в медицине.
Характерные химические реакции
Бензойная кислота, химические свойства которой напрямую зависят от присутствия ароматического кольца, вступает в реакции электрофильного замещения. Причём более подвержен им третий атом углерода, расположенный в равном удалении от карбоксильной группы. Гораздо медленнее протекает замещение в —COOH. Для C6H5COOH характерны те же взаимодействия, что и для карбоновых кислот. При реакции этерификации (со спиртами) образуются эфиры, имеющие приятный аромат. Как и все органические соединения, бензойная кислота сгорает с выделением CO2 и воды. Взаимодействия с основаниями и металлами протекают по карбоксильной группе с образованием солей – бензоатов. Дегидрирование приводит к получению циклоалканов. Характерной химической реакцией (качественной) на C6H5COOH является выделение бензоата железа (III). Он выпадает в виде желтовато-розового осадка вследствие взаимодействия бензойной кислоты с FeCl3.
Получение и очистка
Как уже было описано выше, впервые бензойную кислоту выделили из росного ладана. Это природное соединение представляет собой смолу стираксового дерева. Для этого измельчённое сырье прогревали на песчаной бане и собирали сублимирующиеся кристаллы в небольшом ящичке, оклеенном бумагой. Полученный продукт имел приятный аромат из-за присутствия эфирных масел в росном ладане – коричного и ванильного.

Также использовался метод взаимодействия гиппуровой кислоты с соляной при сильном нагревании. Первую получали путём упаривания мочи травоядных, затем очищали кристаллизацией до исчезновения характерного запаха. А как же протекает современный синтез такого вещества как бензойная кислота? Получение её очень дешёво, просто и экологично. Его проводят при помощи промышленного оксидирования метилбензола KMnO4, либо частичным взаимодействием исходного реагента с O2. Очистка сырья основана на физических свойствах реактива — низкой растворимости бензойной кислоты в холодной воде и высокой - в горячей, и называется перекристаллизацией.
Незаменимый консервант
Рассматривая этикетки пищевых продуктов, вы часто сталкиваетесь с компонентами, закодированными буквой Е. Под этой маркировкой кроются различные красители, ароматизаторы, эмульгаторы, консерванты и усилители вкуса. Бензойную кислоту можно встретить под кодом Е210. Эта пищевая добавка является натуральным консервантом, который вырабатывается в кисломолочных продуктах естественным путём. В природе соединение можно встретить в различных частях растений, смолах, бобровой струе. Используют Е210 при изготовлении пищевых продуктов – соусов, супов, желе, консерваций, напитков. Поскольку компонент мало растворим в воде, чаще берут соли бензойной кислоты, например, бензоат натрия с кодом Е211.

Влияние соединения на организм человека
Консервант Е210, попадая в организм человека, реагирует с белками, образуя гиппуровую кислоту, которая выводится почками. Этот компонент одобрен ассоциацией ВОЗ, но только в концентрации не более 5 мг/кг суточного потребления. В больших дозах бензойная кислота может вызвать поражение печени и почек. Кроме того, стоит остерегаться продуктов, в которых консервант присутствует вкупе с витамином C. Взаимодействие этих компонентов приводит к образованию свободного бензола, являющегося сильнейшим канцерогеном.
Применение
Бензойная кислота нашла применение не только в пищевой промышленности. Её используют в медицине в качестве обеззараживающего и противогрибкового средства, добавляют в отхаркивающие препараты и мази от кожных заболеваний. Реагент является сырьём для химического синтеза фенола, пластификаторов и красителей. Большое значение для парфюмерии имеют эфиры бензойной кислоты. Они применяются как фиксаторы ароматов. Чтобы не получить отравление, следует использовать средства защиты кожи и лёгких, ведь попадание реактива в организм ведёт к ожогам, раздражениям слизистых, тошноте.
Похожие статьи
- Бензоат натрия – распространенная пищевая добавка
- Азелаиновая кислота: действие на кожу, препараты, показания и побочные эффекты, отзывы
- Физико-химические свойства толуола, уравнения реакций
- Брусника: польза и вред для организма. Чем полезны листья и ягоды брусники?
- "Струя бобра": отзывы покупателей. Как действует БАД "Струя бобра"
- "Релиум": инструкция по применению, отзывы, показания, состав, аналоги
- Клюква: где растет и чем полезна?
