Предельные углеводороды: свойства и применение
Сначала рассмотрим предельные углеводороды, особенности их строения, свойства, области применения.
Общие сведения об алканах
К данному классу относятся соединения, которые отвечают общей формуле CnH2n+2. Их молекулы являются линейными, для них характерна только простая связь.
Предельные углеводороды представлены гомологическим рядом метана. Между атомами углерода в их молекулах sp3 гибридизация, для которой характерен угол 109 градусов.
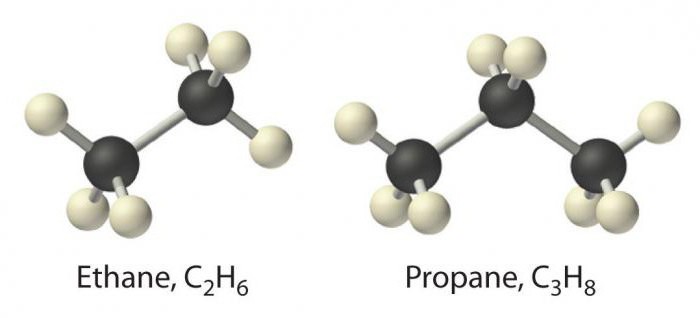
Нахождение в природе
Предельные углеводороды достаточно широко распространены в природе. Например, метан, возглавляющий данный класс СхНу, образуется при разложении животных и растительных организмов в болотистых местах (без доступа воздуха).
Кроме того, это соединение присутствует в угольных шахтах, что часто приводит к серьезным взрывам и гибели шахтеров.
Предельные углеводороды в большом количестве содержатся в твердом, жидком, а также газообразном виде в нефти. Помимо метана в нефти есть пропан, этан, бутан, пентан.
Физические свойства алканов
Данные вещества малорастворимы в воде. Низшие представители ряда являются газами. С увеличением относительной молекулярной массы соединений наблюдается повышение температур кипения и плавления, происходит переход от газообразного состояния к жидкостям, твердым веществам.

Химические свойства
Рассмотрим основные химические свойства предельных углеводородов. Из-за небольшой полярности связи С-С они являются химически малоактивными соединениями.
Среди характерных свойств представителей данного класса отметим радикальное галогенирование. В результате взаимодействия на первой стадии образуется моногалогенпроизводное соединение, а также галогеноводород. Учитывая, что у реакции цепной механизм, замещение продолжается до тех пор, пока вместо водородов не появятся атомы галогена.
Помимо галогенирования, предельные углеводороды вступают во взаимодействие с азотной кислотой. Нитрование приводит к образованию нитроалканов.
Сульфирование связано с замещением атома водорода сульфо-группой, среди продуктов реакции будет алкансульфокислота и вода. Процесс осуществляется при небольшом нагревании реакционной смеси, серная кислота берется в концентрированном виде.
При нормальных условиях алканы демонстрируют стойкость к таким сильным окислителям, как перманганат калия, бихромат калия.
При повышении температуры наблюдается их окисление кислородом воздуха до оксида углерода (4) и водяного пара.
Неполное (каталитическое) окисление приводит к образованию кетонов, альдегидов, карбоновых кислот.
При разрыве связей С-С происходит крекинг, в результате которого из длинной углеродной цепочки формируются соединения с меньшим количеством углеродных атомов.
Среди продуктов дегидрирования непредельные углеводороды и молекулы водорода, происходит реакция при высоких температурах.
При дегироциклизации образуются ароматические углеводороды, которые имеют практическое применение.
Ненасыщенные СхНу
Предельные и непредельные углеводороды могут иметь циклическое или алифатическое строение. Например, алкены, имеющие общую формулу CnH2n, отличаются наличием двойных связей между углеродными атомами.
Именно поэтому для представителей ряда этилена характерны реакции присоединения по двойной связи. Гидрогалогенирование и гидратация осуществляются для несимметричных алкенов по правилу Марковникова. Суть его в том, что при присоединении по двойной связи галогеноводорода или воды атомы галогена или гидроксогруппы присоединяются тому углероду, которые имеет меньшее число Н, а водород идет к первому атому С.
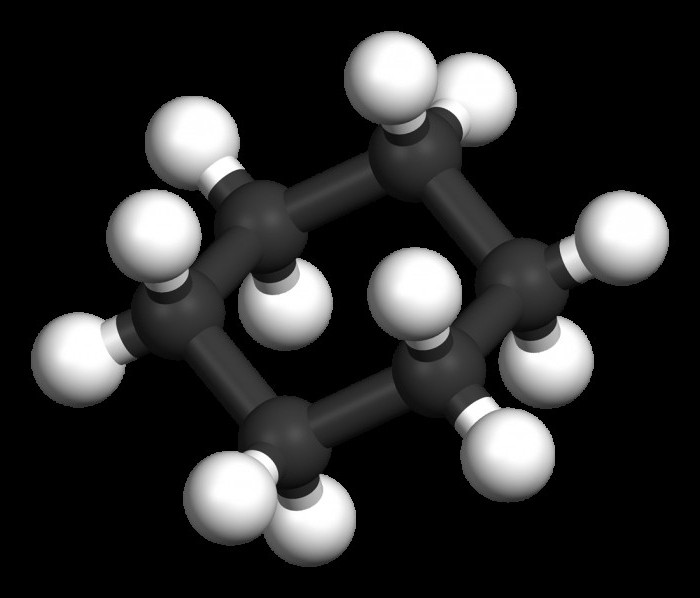
Кроме того, для представителей данного класса органических соединений характерна реакция полимеризации. Она нашла широкое применение в современной химической промышленности. Например, для производства полиэтилена, который востребован в сельском хозяйстве, медицине, в качестве исходного мономера берут этилен. При каталитическом процессе полимеризации наблюдается разрыв двойной связи, в итоге образуется полимерное соединение.
Качественной реакцией на непредельность (присутствие в молекулах двойных и тройных связей) является обесцвечивание бромной (йодной) воды, а также обесцвечивание раствора перманганата калия.
Среди циклических углеводородов, которые в настоящее время нашли широкое применение, следует упомянуть бензол и толуол. Эти СхНу являются типичными представителями ряда ароматических углеводородов, которые имеют общую формулу CnH2n-6.
Бензол, в котором электронная плотность размещается равномерно, считается малоактивным соединением. Большей реакционной способностью обладает толуол, используемый для промышленного производства бензойной кислоты, являющейся отличным консервантом.

Заключение
В органической химии выделяют несколько классов углеводородов, отличающихся между собой по расположению углеродных атомов, наличию одинарных и двойных (тройных) связей. Несмотря на существенные отличия в строении, физических и химических свойствах, все они востребованы в различных сферах промышленности. Среди предельных углеводородов особый интерес вызывает метан, а также его ближайшие гомологи.
Среди диеновых соединений лидирующие показатели при производстве полимерных материалов демонстрируют бутадиен-1,3 и 2метилбутадиен-1,3. Особый интерес вызывают ароматические углеводороды. Именно они являются основой для производства органических красителей, консервантов.
Похожие статьи
- Алканы: общие сведения. Физические и химические свойства алканов
- Углеводороды - это соединения углерода с водородом, не содержащие других элементов. Классификация углеводородов
- Физические свойства алкенов, применение, способы получения
- Что такое бензин? Технология производства, состав и свойства бензина
- Органические вещества. Классы органических веществ
- Алкины: получение и применение
- Физико-химические свойства толуола, уравнения реакций
