Алканы: общие сведения. Физические и химические свойства алканов
Предельные углеводороды – это такие соединения, которые представляют собой молекулы, состоящие из атомов углерода, находящихся в состоянии гибридизации sp3. Они связаны между собой исключительно ковалентными сигма-связями. Название «предельные» или «насыщенные» углеводороды исходит из того факта, что эти соединения не имеют возможности присоединять какие-либо атомы. Они предельны, полностью насыщены. Исключение составляют циклоалканы.
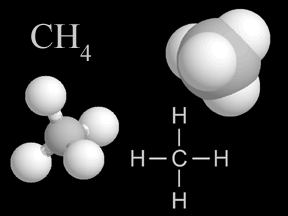
Что такое алканы?
Алканы – это углеводороды предельные, а их углеродная цепь незамкнута и состоит из атомов углерода, связанных между собой при помощи одинарных связей. Она не содержит иных (то есть двойных, как у алкенов, или же тройных, как у алкилов) связей. Алканы также называют парафинами. Это название они получили, так как общеизвестные парафины являются смесью преимущественно данных предельных углеводородов С18-С35 с особой инертностью.
Общие сведения об алканах и их радикалах
Их формула: СnР2n+2, здесь n больше или равно 1. Молярная масса вычисляется по формуле: М = 14n + 2. Характерная особенность: окончания в их названиях - «-ан». Остатки их молекул, которые образуются в результате замещения водородных атомов на иные атомы, имеют название алифатических радикалов, или алкилов. Их обозначают буквой R. Общая формула одновалентных алифатических радикалов: СnР2n+1, здесь n больше или равно 1. Молярная масса алифатических радикалов вычисляется по формуле: М = 14n + 1. Характерная особенность алифатических радикалов: окончания в названиях «-ил». Молекулы алканов имеют свои особенности строения:
- связь С-С характеризуется длиной 0,154 нм;
- связь С-Н характеризуется длиной 0,109 нм;
- валентный угол (угол между связями углерод-углерод) равен 109 градусов и 28 минут.
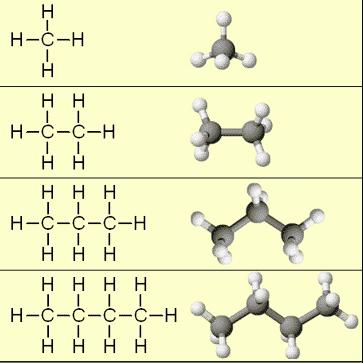
Начинают гомологический ряд алканы: метан, этан, пропан, бутан и так далее.
Физические свойства алканов
Алканы – это вещества, которые не имеют цвета и нерастворимы в воде. Температура, при которой алканы начинают плавиться, и температура, при которой они закипают, повышаются в соответствии с увеличением молекулярной массы и длины углеводородной цепи. От менее разветвленных к более разветвленным алканам температуры кипения и плавления понижаются. Газообразные алканы способны гореть бледно-голубым либо бесцветным пламенем, при этом выделяется довольно много тепла. СН4-С4Н10 представляют собой газы, у которых отсутствует также и запах. С5Н12-С15Н32 – это жидкости, которые обладают специфическим запахом. С15Н32 и так далее – это твердые вещества, которые также не имеют запаха.
Химические свойства алканов
Данные соединения являются малоактивными в химическом плане, что можно объяснить прочностью трудноразрываемых сигма-связей - С-С и С-Н. Также стоит учитывать, что связи С-С неполярны, а С-Н малополярны. Это малополяризуемые виды связей, относящиеся к сигма-виду и, соответственно, разрываться по наибольшей вероятности они станут по механизму гомолитическому, в результате чего будут образовываться радикалы. Таким образом, химические свойства алканов в основном ограничиваются реакциями радикального замещения.
Реакции нитрования
Алканы взаимодействуют только с азотной кислотой с концентрацией 10% либо с оксидом четырехвалентного азота в газовой среде при температуре 140°С. Реакция нитрования алканов носит название реакции Коновалова. В результате образуются нитросоединения и вода: CH4 + азотная кислота (разбавленная) = CH3 – NO2 (нитрометан) + вода.
Реакции горения
Предельные углеводороды очень часто применяются как топливо, что обосновано их способностью к горению: СnР2n+2 + ((3n+1)/2) O2 = (n+1) H2O + n СО2.
Реакции окисления
В химические свойства алканов также входит их способность к окислению. В зависимости от того, какие условия сопровождают реакцию и как их изменяют, можно из одного и того же вещества получить различные конечные продукты. Мягкое окисление метана кислородом при наличии катализатора, ускоряющего реакцию, и температуры около 200 °С может дать в результате следующие вещества:
1) 2СН4 (окисление кислородом) = 2СН3ОН (спирт – метанол).
2) СН4 (окисление кислородом) = СН2О (альдегид – метаналь или формальдегид) + Н2О.
3) 2СН4 (окисление кислородом) = 2НСООН (карбоновая кислота – метановая или муравьиная) + 2Н2О.

Также окисление алканов может производиться в газообразной или жидкой среде воздухом. Такие реакции приводят к образованию высших жирных спиртов и соответствующих кислот.
Отношение к нагреванию
При температурах, не превышающих +150-250°С, обязательно в присутствии катализатора, происходит структурная перестройка органических веществ, которая заключается в изменении порядка соединения атомов. Данный процесс называется изомеризацией, а вещества, полученные в результате реакции – изомерами. Таким образом, из нормального бутана получается его изомер - изобутан. При температурах 300-600°С и наличии катализатора происходит разрыв связей С-Н с образованием молекул водорода (реакции дегидрирования), молекул водорода с замыканием углеродной цепи в цикл (реакции циклизации или ароматизации алканов):
1) 2СН4 = С2Н4 (этен) + 2Н2.
2) 2СН4 = С2Н2 (этин) + 3Н2.
3) С7Н16 (нормальный гептан) = С6Н5 – СН3 (толуол) + 4Н2.
Реакции галогенирования
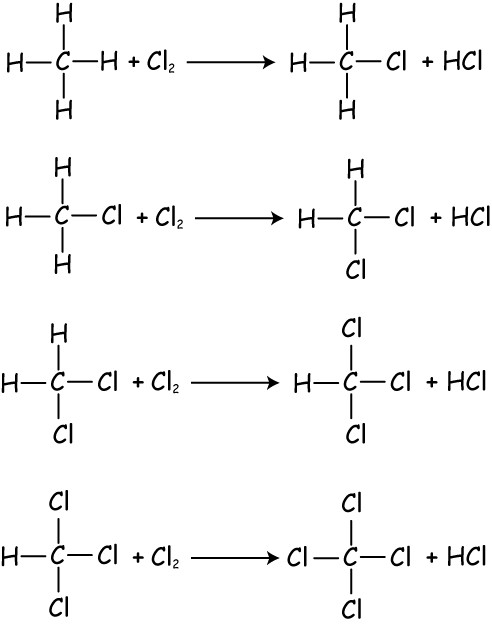
Такие реакции заключаются во введении в молекулу органического вещества галогенов (их атомов), в результате чего образуется связь С-галоген. При взаимодействии алканов с галогенами образуются галогенпроизводные. Данная реакция обладает специфическими особенностями. Она протекает по механизму радикальному, и чтобы ее проинициировать, необходимо на смесь галогенов и алканов воздействовать ультрафиолетовым излучением или же просто нагреть ее. Свойства алканов позволяют реакции галогенирования протекать, пока не будет достигнуто полное замещение на атомы галогена. То есть хлорирование метана не закончится одной стадией и получением метилхлорида. Реакция пойдет далее, будут образовываться все возможные продукты замещения, начиная с хлорметана и заканчивая тетрахлорметаном. Воздействие хлора при данных условиях на другие алканы приведет к образованию различных продуктов, полученных в результате замещения водорода у различных атомов углерода. От температуры, при которой идет реакция, будет зависеть соотношение конечных продуктов и скорость их образования. Чем длиннее углеводородная цепь алкана, тем легче будет идти данная реакция. При галогенировании сначала будет замещаться атом углерода наименее гидрированый (третичный). Первичный вступит в реакцию после всех остальных. Реакция галогенирования будет происходить поэтапно. На первом этапе заместиться только один атом водорода. C растворами галогенов (хлорной и бромной водой) алканы не взаимодействуют.
Реакции сульфохлорирования
Химические свойства алканов также дополняются реакцией сульфохлорирования (она носит название реакции Рида). При воздействии ультрафиолетового излучения алканы способны реагировать со смесью хлора и диоксида серы. В результате образуется хлороводород, а также алкильный радикал, который присоединяет к себе диоксид серы. В результате получается сложное соединение, которое становится стабильным благодаря захвату атома хлора и разрушения очередной его молекулы: R–H + SO2 + Cl2 + ультрафиолетовое излучение = R–SO2Cl + HCl. Образовавшиеся в результате реакции сульфонилхлориды находят широкое применение в производстве поверхностно-активных веществ.
Похожие статьи
- Арены: химические свойства и способы получения
- Алкины: получение и применение
- Изобутан: формула, свойства, применение.
- Как составить изомеры: формулы
- Химические свойства алкадиенов - непредельных углеводородов
- Углеводороды - это соединения углерода с водородом, не содержащие других элементов. Классификация углеводородов
- Гомологический ряд химических соединений
