Структурная формула нитробензола

Нитросоединения являются незаменимыми веществами при синтезе различных азокрасителей, а также в изготовлении пиротехнических и взрывчатых изделий. В частности, нитробензол, формула которого приведена ниже, применяют как основной реагент в большинстве подобных производств, поскольку особенности его химической природы определили важность использования этого простого представителя нитроаренов.
Структура соединения
В химии формула нитробензола изображается в виде ароматического кольца, к которому присоединена нитрогруппа, обладающая ярко выраженными электроакцепторными свойствами. Ион нитрония NO2+ лишает соединение способности к дальнейшему электрофильному замещению. Данный заместитель оттягивает электронную плотность ароматического кольца в структурной формуле нитробензола на себя (пример 1), тем самым делая его мало реакционноспособным к любым подобным реакциям, в том числе к синтезу по Фриделю-Крафтсу.
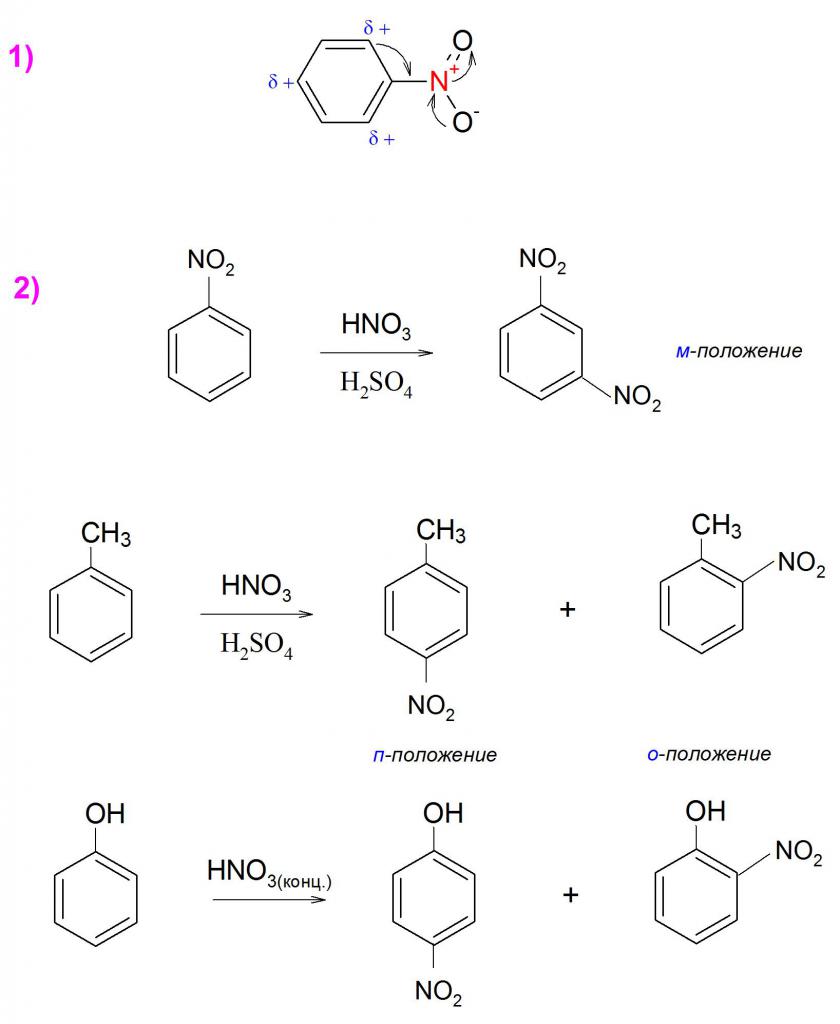
Эта особенность выражается и в неспособности легкого полинитрования подобных соединений, поэтому для прямого получения динитро- и тринитробензолов требуются довольно жесткие условия и дополнительные агенты, например, высокие температуры или катализаторы. Однако присутствие в молекуле каких-либо электродонорных заместителей вроде метиловой или гидроксигруппы облегчает не только реакции присоединения, но и способствуют более простому нуклеофильному замещению. Такая особенность объясняет все тем же оттягиванием плотности кольца, только в данном случае она распределяется между ориентантами согласно силе их индуктивного и мезомерного эффектов.
Особенности заместителя
Поскольку –NO2 является ориентантом 2-ого рода, ее дезактивирующее действие на ароматическое кольцо приводит к определению заместителей, преимущественно, в мета-положение. Но при получении нитропроизводных, например, толуола или фенола ,–NO2 становится в орто- или пара-положения, так как данные заместители за счет добавления электронной плотности (мезомерный эффект) определяют место нитрогруппы в соединении (пример 2). Проще говоря, наличие ориентантов 1-ого рода регулирует постановку –NO2 в химической формуле нитробензола сильнее, чем наличие групп 2-ого рода.
Получение нитробензола
Получение данного вещества в промышленности осуществляется прямым нитрованием бензола смесью серной (H2SO4) и азотной (HNO3) кислот с выходом от 96 до 99% (пример 3). Редко в лабораторных условиях формулу нитробензола синтезируют путем замещения или изменения уже имеющихся групп, поскольку выход в таких реакциях весьма низкий, а сам процесс требует особых условий.
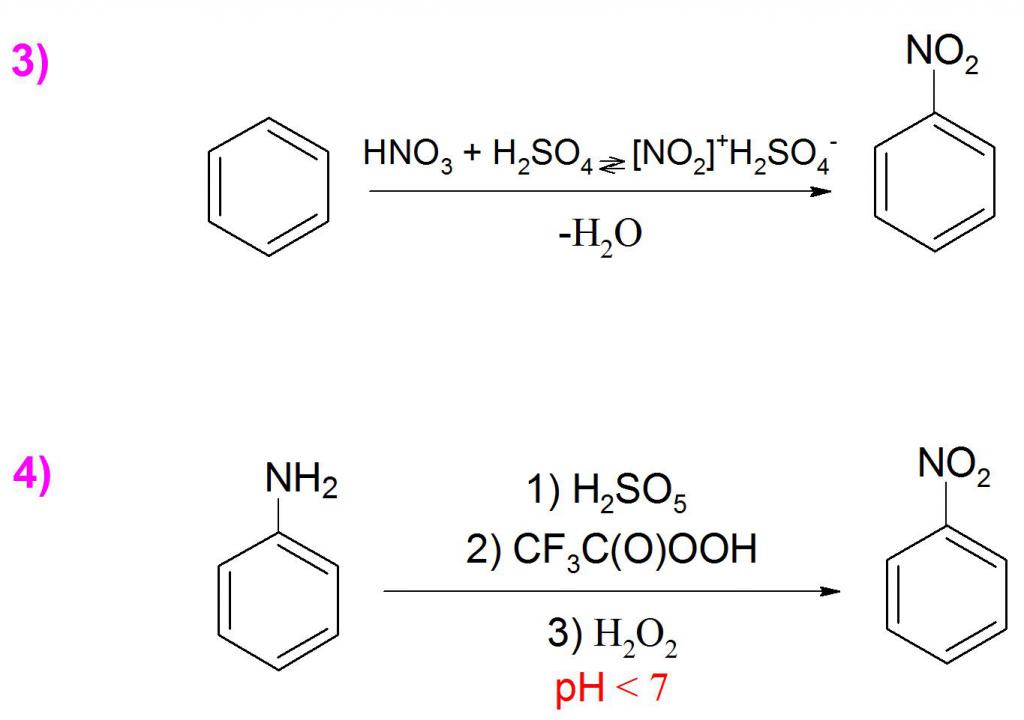
Еще одним способ получения является окисление анилина пероксисоединениями, например, пероксисерной (H2SO5) или перокситрифторуксусной кислотой (CF3C(O)OOH), а также перекисью водорода (H2O2). Данная реакция требует контроля показателей рН-среды, так как в щелочной среде образуется преимущественно азоксибензол (пример 4).
Физические свойства
Нитробензол является маслянистой жидкостью, нерастворимой в воде, со специфическим запахом горького миндаля и очень токсичной для человека. Однако он хорошо растворим в органических растворителях вроде бензола и диэтилового эфира. В случае прямого получения из бензола, его отделяют от непрореагировавшей смеси перегонкой с водяным паром.
Взаимодействие с электрофильными реагентами
Как было сказано выше, наличие нитрогруппы в составе формулы нитробензола делает соединение менее реакционноспособным к электрофильному замещению, однако процесс дальнейшего нитрования все же может проходить под действием сильных кислот и высоких температур.
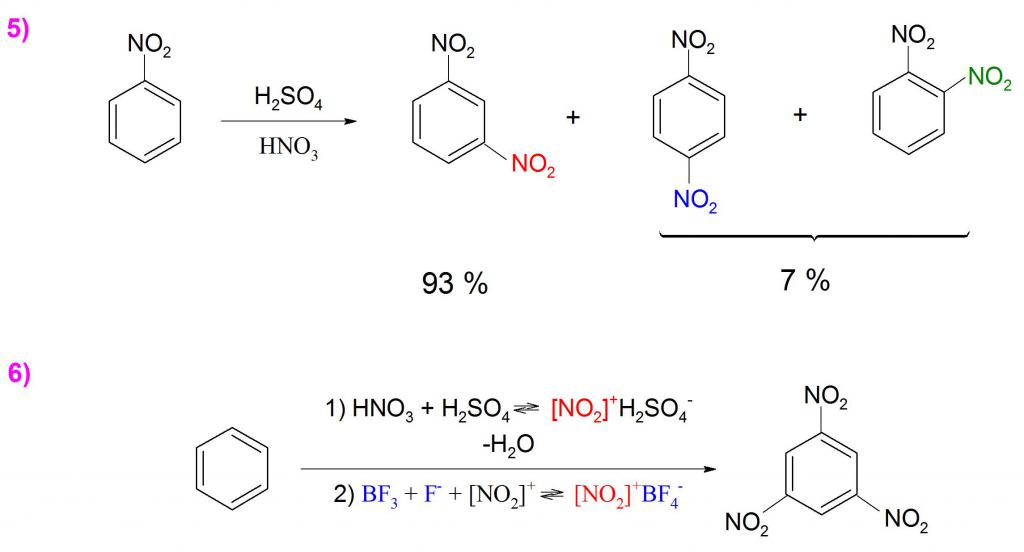
Для получения динитробензола помимо использования нитрующей смеси (H2SO4 + HNO3) требуется значительное термическое воздействие, однако процесс проходит очень трудно, и в результате образуется смесь из большого количества мета-нитросоединения и несущественных долей орто- и пара-производных (пример 5).
Тринитробензол не образуется прямым нитрованием, однако при использовании трехфтористого бора (BF3) и смеси концентрированных H2SO4 и HNO3 его получают с довольно неплохим выходом (пример 6).
Нуклеофильное замещение
По формуле нитробензола можно судить, что сам по себе он обладает слабыми акцепторными свойствами, поэтому может взаимодействовать только с очень сильными электродонорными веществами. Чаще всего реагенты действуют на нитрогруппу с образованием азокси- и азосоединений, однако при подборе правильных окислителей можно получить небольшой выход фенольных производных. Примером может служить синтез изомеров нитрофенола путем прямого внедрения гидроксильной группы в ароматическое кольцо (пример 7). Такие реакции проходят медленно и требуют очень жестких условий.
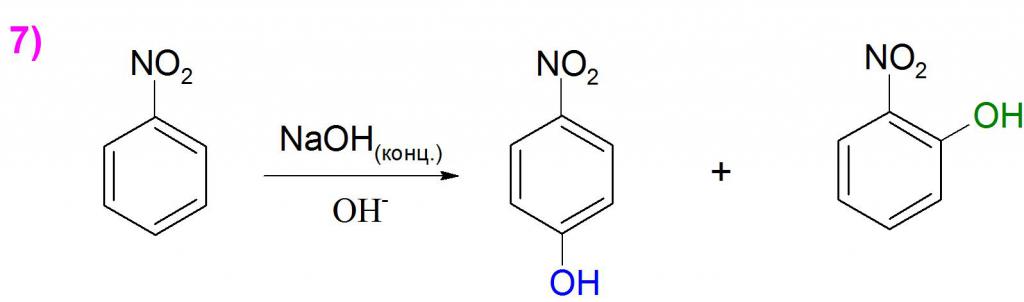
По мере увеличения количества нитрогрупп, такие соединения проявляют гораздо более сильные акцепторные свойства, что облегчает протекание реакции со слабыми нуклеофильными и основными реагентами.
Роль структуры нитробензола в получении первичных аминов
Нитрогруппа является заместителем, способным восстанавливаться до разнообразных продуктов в кислых, нейтральных и щелочных средах. Весь процесс восстановления структурной формулы нитробензола до первичного амина можно представить в виде многостадийного процесса.
В первую очередь, при присоединении 2 атомов водорода образуется нитрозобензол, который в чистом виде выделить весьма трудно (рис. 1А).
Следующим этапом восстановления является получение арилгидроксиламина, который в кислой среде (pH < 6) легко превращается в анилин (рис. 1Б). Также возможно протекание побочной перегруппировки данного промежуточного соединения в аминофенолы (рис. 1В). В чистом виде арилгидроксиламин получают при доведении показателей pH-среды до нейтральных значений.
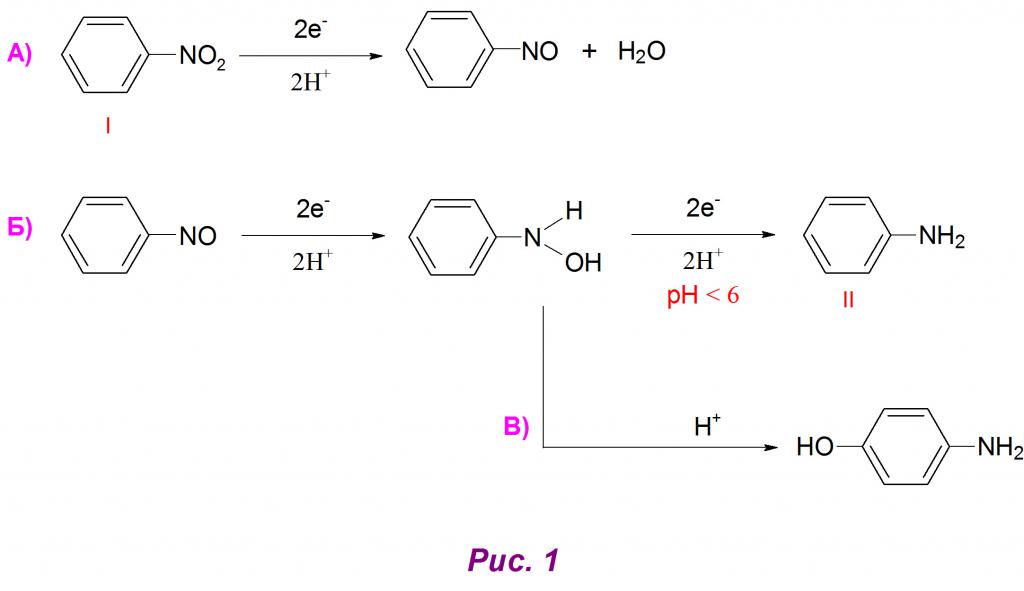
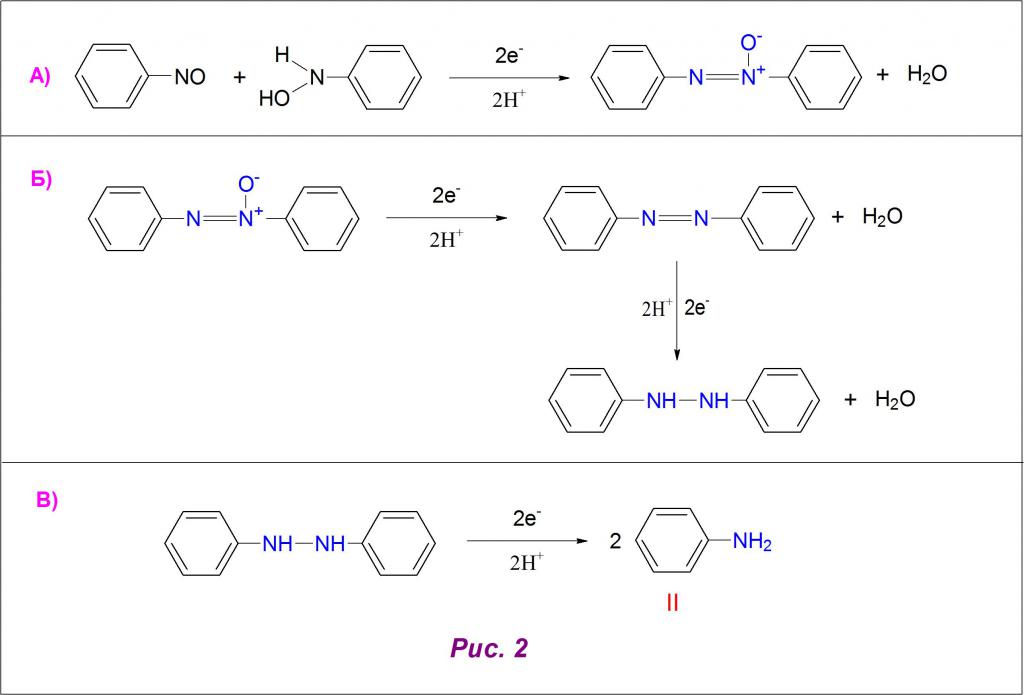
Щелочная среда (pH > 8) влияет на ход реакции с образованием азокси и азосоединений как продуктов конденсации арилгидроксиламина и нитрозобензола, последний в данных условиях восстанавливается очень медленно. Получаемый азоксибензол при подкислении дает азопроизводное (рис. 2А), а оно, в свою очередь, реагирует с атомами водорода с образованием гидразосоединения (рис. 2Б).
При восстановлении последнего получают готовый ариламин (рис. 2В). Структурные формулы нитробензола и анилина представлены под римскими цифрами I и II на рисунках 1 и 2.
Реакция Зинина
В 1842 г. российский ученый Зинин Н.Н. синтезировал из нитробензола формулу анилина путем восстановления первого сульфидом аммония ((NH4)2S) (пример 8).
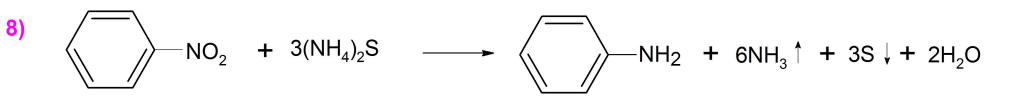
Со временем ученый подтвердил целесообразность использования реакции при получении ароматических аминов из других нитросоединений, что позволило развить крупномасштабное производство синтетических красителей, взрывчатых веществ, а также специальных фармацевтических препаратов.
Похожие статьи
- Структурированная вода в домашних условиях: польза, как сделать?
- Химические свойства аренов. Общая формула и характеристика аренов
- Как выглядит формула анилина
- Что такое бром? Химический элемент бром: формула, свойства
- Натрий бромид - незаслуженно забытое лекарство
- Что такое формальдегид, и чем он опасен?
- Изобутан: формула, свойства, применение.
