Химические свойства аренов. Общая формула и характеристика аренов

Ароматические углеводороды, называемые еще аренами, представлены органическими веществами. В составе их молекул присутствуют одно или несколько бензольных ядер (колец). Бензол, также называемый бензеном, - первый представитель гомологического ряда аренов. Химические свойства, строение молекулы и типы химических связей в его молекуле имеют ряд особенностей. Мы рассмотрим их в нашей статье, а также познакомимся с другими соединениями, входящими в группу ароматических углеводородов.
Как установили структурную формулу аренов
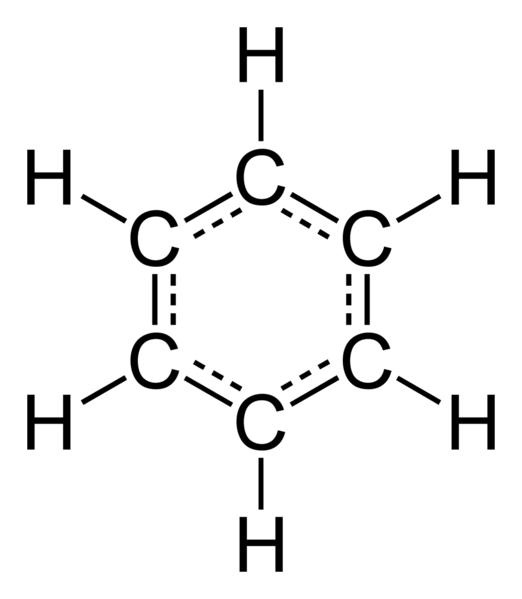
В 1865 году немецкий ученый Ф. Кекуле предложил пространственную модель простейшего арена – бензола. Она имела вид плоского шестиугольника, в вершинах которого находились атомы углерода, которые соединялись между собой тремя простыми и двойными связями, чередующимися друг с другом. Однако выявленные экспериментальным путем химические свойства аренов не соответствовали предложенной Ф. Кекуле формуле. Например, бензол не обесцвечивал раствор перманганата калия и бромную воду, что указывало на отсутствие в молекулах аренов пи-связей. Каково же строение бензола на самом деле? Ни одинарных, ни двойных связей у ароматических углеводородов нет. Опытным путем установлено, что эти соединения содержат между атомами углерода равноценный тип химической связи, получившей название полуторной, или ароматической. Именно поэтому они не вступают в реакцию окисления с растворами KMnO4 и Br2. Выведена общая формула аренов – CnH2n-6. Все специфические свойства ароматических соединений можно объяснить их электронным строением, которое мы изучим далее.
Электронная формула
На примере бензола установим, как связаны между собой атомы карбона. Выяснилось, что все шесть углеродных атомов находятся в виде sp2-гибридизации. Карбон соединен с атомом водорода и двумя соседними углеродными атомами тремя сигма-связями. Вот благодаря чему формируется плоская шестиугольная форма молекулы. Однако у каждого карбонового атома остается еще по одной отрицательно заряженной частице, не задействованной в гибридизации. Ее электронное облако имеет вид гантели и располагается над и под плоскостью шестиугольника, называемого бензольным кольцом. Далее все шесть гантелей перекрываются и образуют общую ароматическую (полуторную) связь. Именно она и обусловливает все физические и химические характеристики веществ. Таково электронное строение аренов.

Что такое бензол?
Лучше понять особенности ароматических углеводородов поможет знакомство с первым представителем этого класса – бензеном. Легко подвижная, горючая бесцветная жидкость со своеобразным запахом, не растворимая в воде, – это бензол. Как само соединение, так и его пары токсичны. Согласно общей формуле аренов количественный и качественный состав молекулы вещества можно выразить в таком виде: C6H6. Как и для других ароматических углеводородов - толуола, антрацена или нафталина, для бензола типичными будут реакции горения и замещения атомов водорода бензольного ядра. Особенностью жесткого окисления всех ароматических соединений является сильно коптящее пламя. Смесь паров бензола с воздухом взрывоопасна, поэтому все опыты с веществом в лаборатории проводятся только в вытяжном шкафу. Бензол, как и другие ароматические вещества, не присоединяет ни воду, ни галогеноводороды. Он также не обесцвечивает раствор перманганата калия и бромную воду. Гомологи бензола, например толуол или кумол, могут окисляться, в этом случае реакции подвергается не само бензольное кольцо, а только радикал.

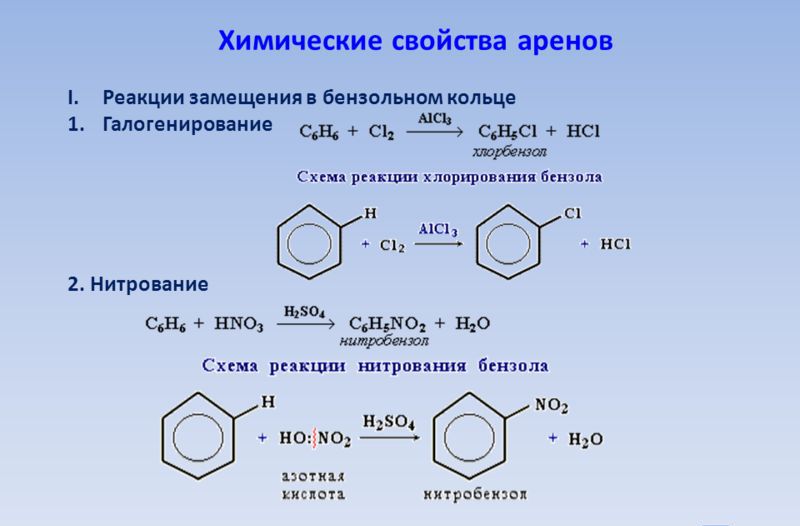
Химические свойства аренов
К каким же реакциям способны соединения, содержащие в своем составе бензольные кольца и полуторную связь между атомами углерода? Это, прежде всего, реакции замещения, проходящие у них намного легче, чем у алканов. Представим запись каталитической реакции между бензолом и бромом с участием бромида трехвалентного железа, приводящей к образованию бромбензола – нерастворимой в воде бесцветной жидкости:
C6H6+ Br2→ C6H5Br +HBr
Если в процессе применять хлористый алюминий как катализатор, можно добиться полного замещения в молекуле бензола всех водородных атомов. В этом случае образуется гексахлорбензол, бесцветные кристаллы которого применяют в методах защиты семян культурных растений и в процессах обработки древесины для продления сроков ее хранения. Для более полной характеристики аренов добавим некоторые факты. Чтобы ароматические соединения могли присоединять другие вещества, например хлор, нужны специальные условия. В нашем случае это будет ультрафиолетовое облучение реагирующей смеси. Продуктом реакции будет гексахлорциклогексан, или, как его еще называют, гексахлоран. Это известное в сельском хозяйстве средство – инсектицид, применяемый для борьбы с насекомыми-вредителями.

Как и для чего получают нитробензол?
Продолжим обзор химических свойств аренов. Применяя в одной реакции концентрированные азотную и сульфатную кислоты (нитрующую смесь), можно из бензола получить важный для органического синтеза продукт – нитробензол. Это жидкость бледно-желтого цвета, маслянистая на вид, имеет миндальный запах. Она нерастворима в воде, но часто используется как растворитель для многих органических веществ: лаков, жиров и т.д. Нитробензол является многотоннажным продуктом, так как используется в качестве сырья для получения анилина. Это вещество настолько значимо для химической промышленности, что стоит остановиться на нем более подробно. Известным российским химиком Н.Н. Зининым в 1842 году из нитробензола реакцией восстановления сульфидом аммония был получен анилин. В современных условиях получил распространение контактный метод, при котором смесь паров водорода и нитробензола пропускают при температуре 300 °C над катализатором. Полученный ароматический амин в дальнейшем используют для производства взрывчатых веществ, красителей, лекарственных препаратов.
Из чего добывают ароматические углеводороды?
Наиболее перспективным является получение аренов из продукта коксования каменного угля и в процессе нефтепереработки. Циклопарафины, содержащиеся в каменноугольной смоле, подвергают гидрогенизации над катализатором при температуре до 300 °C, продуктом реакции будет бензол. Дегидрирование алканов также приводит к образованию ароматических углеводородов. Реакцией Зелинского-Казанского бензол получают из этина, пропуская его через трубку с активированным углем, разогретую до 600 °C. Получение аренов, например толуола, осуществляют с помощью реакции Фриделя - Крафтса. Можно также добывать метилбензол (толуол), используя гептан. Полученные виды аренов применяют как растворители и добавки к моторному топливу, в производстве анилиновых красителей и ядохимикатов.

Нафталин
В 50-70-х годах прошлого века одним из излюбленных средств защиты меховых и шерстяных изделий от моли в быту являлся нафталин. При его длительном применении одежда приобретала характерный, очень стойкий запах. Однако более важным является применение нафталина в качестве сырья для синтеза лекарственных средств, красителей, взрывчатых веществ. Основные способы его получения основаны на переработке продуктов нефтеперегонки и отходов этиленового производства – пиролизной смолы. Вещество, в отличие от бензола, содержит два бензольных ядра, поэтому реакции нитрования и галогенирования проходят у него быстрее. Продолжая приводить примеры аренов, остановимся на еще одном, важном для промышленности ароматическом углеводороде – винилбензоле.
Стирол
Современная индустрия строительных материалов невозможна без полимерных материалов: легких в обработке, прочных и износоустойчивых. Полимеры, полученные из винилбензола, например, такие, как пенопласт (вспененный полистирол), пластики САН и АБС, используются в производстве натяжных потолков, напольных покрытий, утеплителей стен. Стирол получают из этилбензола в виде бесцветной, горючей жидкости со своеобразным запахом. В дальнейшем ее подвергают полимеризации и добывают твердую стекловидную массу – полистирол. Он и служит исходным продуктом в производстве вышеназванных строительных материалов. Винилбензол применяют в качестве растворителя, используют наряду с бутадиеном в реакции полимеризации, приводящей к синтезу бутадиен-стирольных каучуков.

Номенклатура ароматических соединений
Название аренов по международной классификации ИЮПАК включает в себя обозначение заместителя, к которому добавляют слово "бензол". Например, C6H5CH3 - метилбензол, C6H5C2H3 – винилбензол. У этих соединений есть и тривиальные названия, так, первое соединение именуют толуолом, второе – стиролом. Арены могут содержать два заместителя, например два метильных радикала. Они способны присоединяться к карбоновому циклу в трех позициях: при 1 и 2 углеродных атомах, тогда говорят об ортоположении заместителей. Если радикалы располагаются при 1 и 3 карбоновых частицах, то речь идет о метаположении заместителей, при 1 и 4 атомах углерода – это паразамещение. Высшие гомологи бензола можно представить как производные насыщенных углеводородов, в молекулах которых один атом водорода замещен фенильным радикалом C6H5-. Например, соединение с формулой C6H5C6H13 будет иметь название "фенилгексан".
В нашей статье мы изучили химические свойства аренов, а также дали характеристику их свойствам и применению в промышленности.
Похожие статьи
- Арены: химические свойства и способы получения
- Химические свойства алкадиенов - непредельных углеводородов
- Реакция Вагнера: механизм, роль в органической химии, применение
- Алканы: общие сведения. Физические и химические свойства алканов
- Что такое нафталин? Свойства вещества, сферы применения
- Циклоалканы: химические свойства, применение
- Бромная вода: ее свойства и особенности
