Осмотическое давление в природе и жизни человека
В предоставленном вашему обозрению материале будут предоставлены сведения об осмотическом давлении (д-ние). Ниже будут рассмотрены: формулировка термина, особенности и свойства, способы измерения давления, взаимосвязь с биологией и связь с растворами (р-р) разных видов.
Знакомство с осмотическим давлением
Осмотическое давление – это избыток гидростатического д-ния, оказываемого на растворы. При этом сами р-ры должны быть отделены мембраной полупроницаемого типа от чистых растворителей. Процесс диффузионного растворения сквозь мембрану в таких условиях не происходит. Целью такого давления является стремление создать равный баланс между концентрациями каких-либо растворов, а средством выступает встреча молекулярной диффузии между растворенным веществом и растворителем. Осмотическое давление обозначается буквой "π" (пи).
О свойствах
Осмотическое давление обладает явлением тоничности, которое представляет собой градиентную меру осмотического давления. Другими словами, это потенциал водного различия пары р-ров, отделенных между собой полупроницаемой мембраной. Гипертоническим раствором называют вещество, имеющее в сравнении с другим р-ром более высокий показатель осмотического давления. Гипотонический раствор, наоборот, имеет более низкий показатель осмотического д-ния.
Если такой р-р поместить в замкнутое пространство, например в кровяную клетку, то мы увидим, что осмотическое давление может разорвать клеточную мембрану. Лекарственные средства, вводящиеся в кровь, сначала смешивают с изотоническим р-ром, доводя их до растворения как раз из-за этой причины. При этом хлорид натрия в растворе должен содержаться в количестве, способном уравновесить осмотическое д-ние клеточной жидкости.
В случае если лекарства вводимого типа изготавливались на основе воды либо сильно разбавленных растворов, осмотическое д-ние разрывало бы кровяные клетки путем принуждения проникновения в них воды. Создание р-ров с использованием слишком большой концентрации веществ будет принуждать воду покидать клетки, и в итоги они будут сжиматься. Для этого достаточно от трех до десяти процентов хлорида натрия в р-ре.
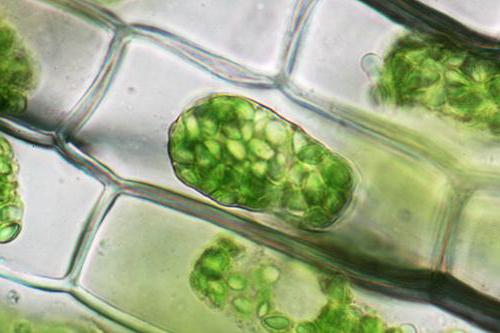
Растительные клетки, в отличие от животных, буду подвергаться отрыву от клеточной оболочки, всего ее содержимого, за исключением внешней клеточной оболочки, но вместе с мембраной. Такое явление называют плазмолизом. Деплазмолизом, в свою очередь, называется процесс, наблюдаемый при перемещении сжавшихся клеток в р-р более разбавленного типа.
Взаимосвязь давления и раствора
Химическая природа растворенных веществ в соединении не влияет на величину осмотического д-ния. Ее показатель зависит от количества этих веществ в р-ре. Следовательно, мы видим, что осмотическое д-ние - это коллигативное свойство раствора. Давление будет увеличиваться с увеличением концентрации активных веществ в р-ре. Именно на это указывает закон осмотического давления. Формула выражается довольно просто:
π = i · C · R · T,
где изотонический коэффициент обозначается буквой i, молярный уровень концентрации р-ра выражается при помощи C (моль/м3), универсальный газовый показатель его постоянной обозначают буквой R, а T – это термодинамический уровень температуры р-ра.
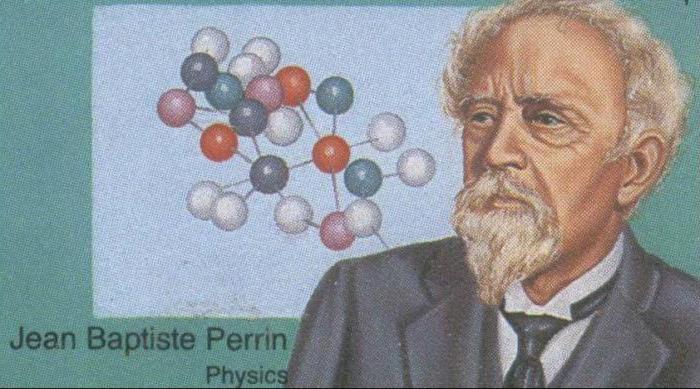
Формула схожа с законом идеального газа. В воздухе частицы идеального газа в среде растворителя вязкого типа схожестью своих свойств также указывают на их общие черты. Данное заявление подтверждает ряд опытов, проведенных Ж.Б. Перреном в 1906 году. Он наблюдал процесс распределения эмульсионных частичек гуммигутовой смолы в водной толще, которые в целом подчинялись закону Больцмана.
Существует понятие об онкотическом осмотическом давлении, которое зависит от количества белков в растворе. В результате голодания или болезней почек уровень концентрации белков понизится. По этой причине онкотическое давление будет падать, и начнут появляться отеки онкотической природы. Будет происходить переход воды из тканей в сосуды, в те места, где πонк больше. Гнойные процессы вызывают возрастание показателя πонк в два-три раза. Это объясняется разрушением белков, что ведет за собой увеличение числа частичек.
Стабильный показатель осмотического д-ния должен быть приблизительно равен 7.7 атм. По этой причине изотонические р-ры обычно содержат около πплазмы = 7.7 атм. Растворы, у которых π превышает πплазмы, используют для удаления гноя из ран или устранения отеков аллергической природы. А также они являются слабительными лекарствами.
Термодинамический взгляд на осмотическое давление
Формулу Вант-Гоффа, применяемую для осмотического д-ния, можно обосновать с термодинамической точки зрения.

Свободная энергия, находясь в растворе, будет соответствовать G = G0 + RTlnxA + πVC. Молярная часть раствора будет обозначаться xA, VC – это показатель молярного объема. Член πVC эквивалентен внесению свободной энергии давления внешнего характера. Чистый растворитель имеет G = G0. Если показатель равновесия ∇G растворителя соответствует показателю 0, то мы получаем:
0 = ∇G = G0 + RTlnxA + πVC - G0 = RTlnxA + πVC.
Полученную запись можно преобразовать в формулу Вант-Гоффа.
О коллоидных растворах
Осмотическое давление раствора может возникать при наличии двух условий:
- Необходима полупроницаемая перегородка (мембрана).
- Присутствие двух р-ров с обеих сторон мембраны, при этом р-ры должны быть разной концентрации.
Мембрана клетки может пропускать частички конкретных размеров, например впускать и выпускать молекулу воды, но оказывать противоположный эффект на C2H6O. Таким образом, при помощи специальных материалов, которым тоже свойственна подобная возможность разделения, можно разделять различные компоненты смеси.
Осмотическое д-ние растворов вычисляют при помощи π = cRT. Эта формула была выведена Вант-Гоффом в 1885 году, а основой для ее нахождения послужили опыты Пфеффера с пористым фарфором.
Тургор в клетке
Как осмос, так и осмотическое д-ние являются очень важными составными многих биологических систем. Если структура содержит полупроницаемую перегородку (определенную ткань или клеточную оболочку), то показатель постоянного водного осмоса будет создавать слишком большое гидростатическое д-ние, и в результате образуется тургор, который обеспечит показатели упругости и прочности тканей выдержкой.
Возможно, явление гемолиза, которое представляет собой разрыв оболочки клетки, например эритроцита в результате его чрезмерного набухания при помещении в очищенную воду.
Плазмолиз
Противоположные процессы будут происходить при помещении клетки в растворы соли концентрированного типа: вода, содержащаяся в клетке, будет диффундировать в солевые растворы, через мембрану. В результате клетка начнет сморщиваться, утрачивая тургор стабильного состояния. Такое явление называют плазмолизом. Однако тургор может восстанавливаться, если поместить плазмолизованную клетку в протоплазматическую воду. Клеточный объем будет сохраняться только в изотоническом р-ре с одинаковой концентрацией (постоянным осмотическим д-нием).
Подводя итоги
Данный материал позволил читателю ознакомиться с понятием осмотического д-ния, сформулировать общее представление о нем и узнать множество интересного. Например, сходство расчета д-ния с формулой Вант-Гоффа, схожесть с идеальным газом, роль в биологических процессах и следствия, которые они могут вызывать, а именно - тургор, плазмолиз, гемолиз и многое другое.
Похожие статьи
- "Экспортал": инструкция по применению, показания, аналоги, отзывы
- Что такое корневое давление растений, описание процесса
- Лекарство «Калий хлористый» - своевременная помощь для сердца
- Обратный осмос: польза или вред, принцип работы и характеристики
- Лучшие изотонические напитки
- Медленные углеводы: список продуктов
- Что такое тургор кожи и от чего он зависит
